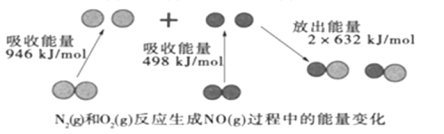
题目内容
【题目】钠通常保存在_________中,加热时,钠可以在空气中_________,发出________火焰,生成____________色固体。化学方程式为________________________。
【答案】煤油或石蜡油 燃烧 黄色 淡黄色 2Na+O2![]() Na2O2
Na2O2
【解析】
钠性质很活泼,易和水、氧气反应,所以保存钠时要隔绝空气和水;钠和氧气反应生成过氧化钠,生成淡黄色固体Na2O2,以此解答。
钠性质很活泼,易和水、氧气反应,所以保存钠时要隔绝空气和水,钠和煤油不反应,且密度大于煤油,所以保存钠可以放在煤油或石蜡油中;钠可以在空气中燃烧,发出黄色火焰,生成淡黄色固体Na2O2,化学方程式为2Na+O2![]() Na2O2,故答案为:煤油或石蜡油;燃烧;黄色;淡黄色;2Na+O2
Na2O2,故答案为:煤油或石蜡油;燃烧;黄色;淡黄色;2Na+O2![]() Na2O2。
Na2O2。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】工业上可以用天青石生产碳酸锶后的含锶废渣制备高纯六水氯化锶(SrCl26H2O),含锶废渣主要成分为SrCO3,且含钡、铁、钙等元素。六水氯化锶是一种无色长针状晶体,易溶于水,微溶于无水乙醇和丙酮,下面为实验室模拟SrCl26H2O的制作流程:
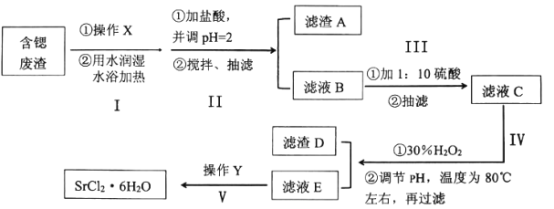
已知:①SrSO4微溶于水;
②SrCl26H2O在61.5℃以上即会失去4个结晶水生成SrCl22H2O。
(1)关于上述实验操作下列说法不正确的是___。
A.步骤I中操作X为研磨粉碎,可以增大反应接触面积
B.步骤III为提高产率,可以用滤液淋洗布氏漏斗中的滤渣
C.抽滤时,如果溶液有强酸性,可以用玻璃纤维代替滤纸
D.减压过滤不宜过滤胶状沉淀,因为胶状沉淀会在滤纸上形成一层密实的沉淀
E.步骤IV中的温度控制在80℃左右,可以用水浴加热,也可以用油浴或砂浴加热代替,更安全
(2)下表为实验中硫酸加入量对溶液中Ba2+和Sr2+含量的影响,实验发现在步骤III中加入硫酸量过量20%较合适,请解释原因:___。
硫酸加入量/mL | 4.50 | 4.95 | 5.40 | 5.85 | 6.30 |
Ba2+/(g/L) | 0.37 | 0.21 | 0.13 | 0.11 | 0.10 |
Sr2+/(g/L) | 90.21 | 89.86 | 89.57 | 89.23 | 88.90 |
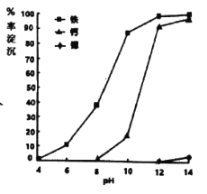
(3)①步骤IV调节pH时,为避免引入新的杂质,最适宜加入的试剂为___,如图为在80℃时,pH对除杂的影响,通过加入试剂将pH调至___。
②往滤渣D中加入NaClO溶液,发生反应的离子方程式为:___。
(4)在步骤V中,若要从滤液E通过操作Y得到大颗粒的高纯六水氯化锶晶体,操作Y包含下列步骤中的某几项,请选择合适的操作并排序。(填相应步骤的字母)
滤液E→(_____)→(_____)→(_____)→抽滤→(_____)→(_____)
a.蒸发浓缩至有大量晶体析出
b.在过饱和溶液中加入晶种
c.6l.5℃以上减压蒸发浓缩
d.6l.5℃以下减压蒸发浓缩
e.往溶液中加入无水乙醇
f.在30℃真空烘箱中干燥
g.在室温下缓慢冷却结晶
h.用氯化锶饱和溶液洗涤晶体
I.用冷水洗涤晶体
(5)为侧定所制SrCl26H2O晶体的纯度,取1.12g实验制得的产物加水溶解,配成100mL溶液,用移液管取出25mL于锥形瓶中,滴入几滴K2CrO4
①判断滴定终点的现象为___;
②实验时未采用棕色滴定管滴定,会使测得的晶体纯度___(填“偏高”、“偏低”或“不变”)。
【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
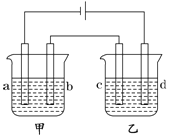
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。