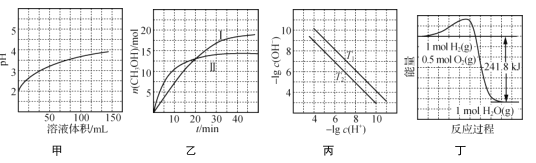
题目内容
【题目】溴化苯(基)硒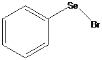 有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
有剧毒,是一种合成有机硒化合物的重要中间体。可由乙酸基笨基硒在四氯化碳中与溴反应经乙酸处理得到,回答下列问题:
(1)Br原子核外能量高的能层符号是__________,其基态原子价电子排布式为_______。
(2)C、N、O三种原子的第一电离能由大到小的顾序为_______。
(3)乙酸分子中碳原子的杂化方式为_______。
(4) H2Se的沸点_______(填“>”“<”或“=”)H2S,原因是_______。
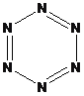
(5)晶体氮(N6)的结构如下图所示,其熔点为70℃,晶体氮中存在的作力有_______。
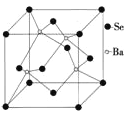
(6)BaSe可用于光电池,其晶胞结构如上图所示,晶胞参数a=0.786nm,NA代表阿伏加徳罗常数,列式计算BaSe晶胞密度为____gcm-3。
【答案】N 4s24p5 N>O>C sp2、sp3 > H2Se和H2S均为分子晶体,且结构相似,H2Se的相对分子质量大,分子间作用力大,沸点高 分子间作用力、共价键 ![]()
【解析】
(1)基态Br原子的核外电子排布为1s22s22p63s23p63d104s24p5,Br占据的最高的能层为第4层,其符号为N;Br基态原子价电子排布式为4s24p5;
(2)同周期元素从左到右第一电离能逐渐增大,由于N的价层电子排布为2s22p3,2p处于半满状态,较稳定,其第一电离能大于相邻的元素,则C、N、O三种原子的第一电离能由大到小的顺序为N>O>C;
(3)乙酸的结构式为 ,-CH3中的C原子,形成4根键,其杂化类型为sp3;-COOH中的碳原子,形成3个σ键,1个π键,其杂化类型为sp2,因此乙酸分子中碳原子的杂化方式为sp2、sp3;
,-CH3中的C原子,形成4根键,其杂化类型为sp3;-COOH中的碳原子,形成3个σ键,1个π键,其杂化类型为sp2,因此乙酸分子中碳原子的杂化方式为sp2、sp3;
(4)Se和S为同主族元素,其形成的氢化物H2Se和H2S,结构相似,形成的晶体均为分子晶体;分子晶体的沸点和分子间作用力有关。相对分子质量越大,分子间作用力越大;相对分子质量越大,晶体沸点越高;H2Se的相对分子质量大于H2S,则H2Se的沸点大于H2S的沸点,原因是H2Se和H2S均为分子晶体,且结构相似,H2Se的相对分子质量大,分子间作用力大,沸点高;
(5)晶体氮(N6)的熔点为70℃,可知该晶体为分子晶体,则分子与分子之间存在分子间作用力,分子中N原子和N原子之间存在共价键;则晶体氮中存在的作用力有分子间作用力和共价键;
(6)根据晶胞结构,可知Se位于顶点和面心,顶点的Se被8个晶胞所共有,面心的Se被2个晶胞所共有,则此晶胞中Se有![]() 个;4个Ba均位于晶胞内,为此晶胞所有,则一个晶胞中含有4个Ba和4个Se,其的质量为
个;4个Ba均位于晶胞内,为此晶胞所有,则一个晶胞中含有4个Ba和4个Se,其的质量为![]() g;晶胞参数a=0.786nm,则晶胞的体积为
g;晶胞参数a=0.786nm,则晶胞的体积为![]() ,则晶胞的密度
,则晶胞的密度![]() 。
。

【题目】下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
4 | ⑧ | ⑨ | ⑩ |
(1)写出下列元素的元素符号:① _____ ②_____ ⑩_____
(2)在这些元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是_____。
(3)这些元素的最高价氧化物对应水化物中,酸性最强的是_________;呈两性氢氧化物是__,它在水中的电离方程式为_______
(4)在⑥与⑩的单质中,化学性质较活泼的是____,因为______(用化学方程式表示)