题目内容
18.下列说法不正确的是( )| A. | 同族元素,随着电子层的增加,I1逐渐增大 | |
| B. | 通常情况下,电离能I1<I2<I3 | |
| C. | 同周期元素,随着核电荷数的增加,I1呈增大趋势 | |
| D. | 电离能越小,元素的金属性越强 |
分析 A、同主族元素自上而下,随电子层增大,原子核等于最外层电子引力减弱,元素的第一电离能逐渐减小.
B、同一原子失去电子的能力越来越难.
C、同周期元素,随着核电荷数的增加,最外层电子数越来越多,又第ⅡA和第ⅤA族处于稳定结构,所以第一电离能呈增大的趋势.
D、同周期从左到右第一电离能增大,但第IIA和第VA族反常.
解答 解:A、同主族元素自上而下,随电子层增大,元素的第一电离能逐渐减小,故A错误;
B、因为同一原子失去电子的能力越来越难,所以其电离能的大小关系为I1<I2<I3,故B正确;
C、同周期元素的第一电离能呈增大的趋势,但同周期第ⅡA和第ⅤA族出现反常,故C正确;
D、同周期从左到右第一电离能增大,但第IIA和第VA族反常,如第一电离能:Mg>Al,Al的第一电离能越小,但Al的金属活泼性弱,故D错误;
故选:AD.
点评 本题考查同周期、同主族元素性质的递变规律与元素周期律实质,比较基础,注意基础知识的掌握.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
9.下列物质中不属于醇类的是( )
| A. | C3H7OH | B. | 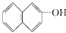 | C. | CH2OHCHOHCH2OH | D. | 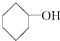 |
6.下列材料都具有一定的特殊性能,其中是由长周期的主族元素和副族元素形成的是( )
| A. | 透明陶瓷材料硒化锌 | B. | SO2和O2反应的催化剂五氧化二钒 | ||
| C. | 半导体材料砷化镓 | D. | 吸氢材料镧镍合金 |
13.某元素的一种同位素的原子AZX,与1H原子组成HmX分子,在agHmX中所含中子的物质的量是( )
| A. | $\frac{a}{A}$(A-Z+m)mol | B. | $\frac{a}{A}$(A-Z)mol | C. | $\frac{a}{A+m}$(A-Z)mol | D. | $\frac{a}{A+m}$(A-Z+m)mol |
3.铁是一种应用广泛的金属.下列有关铁的说法错误的是( )
| A. | 铁在氧气中燃烧生成四氧化三铁 | B. | 常温下,铁在浓硫酸中会发生钝化 | ||
| C. | 铁与盐酸反应生成氯化铁与氢气 | D. | 铁是一种银白色金属 |
7.硅橡胶 是由
是由 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )
 是由
是由 经两种反应而制得的,这两种反应依次是( )
经两种反应而制得的,这两种反应依次是( )| A. | 消去、加聚 | B. | 水解、缩聚 | C. | 氧化、缩聚 | D. | 取代、加聚 |
8. 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
 如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )| A. | $\frac{8M}{{N}_{A}•{a}^{3}}$g.cm-3 | B. | $\frac{M{a}^{3}}{8{N}_{A}}$gcm-3 | C. | $\frac{M}{{N}_{A}•{a}^{3}}$g.cm-3 | D. | $\frac{Ma}{{N}_{A}}$g.cm |
