题目内容
13.某元素的一种同位素的原子AZX,与1H原子组成HmX分子,在agHmX中所含中子的物质的量是( )| A. | $\frac{a}{A}$(A-Z+m)mol | B. | $\frac{a}{A}$(A-Z)mol | C. | $\frac{a}{A+m}$(A-Z)mol | D. | $\frac{a}{A+m}$(A-Z+m)mol |
分析 根据中子数=质量数-质子数,计算X原子中子数,进而计算每个HmX分子含有中子数,根据n=$\frac{m}{M}$计算HmX的物质的量,结合每个分子含有中子数计算.
解答 解:某元素的一种同位素X的原子质量数为A,含N个质子,则中子数为(A-Z),则每个HmX分子含有中子数为(A-Z),ag HmX的物质的量为$\frac{ag}{(A+m)g/mol}$=$\frac{a}{A+m}$mol,故含有中子物质的量为$\frac{a}{A+m}(A-Z)$mol;
故选C.
点评 本题考查物质的量有关计算、原子结构,比较基础,属于字母型计算,一定程度上增大计算难度.

练习册系列答案
相关题目
3. 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)实验①的目的是验证其他条件相同时,温度对化学反应速率的影响,实验中滴加FeCl3溶液的目的是催化剂,加快化学反应速率.
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是③(填序号).
①加热5%H2O2溶液 ②分别加入5mL5%H2O2③加入1~2 滴1mol/L FeCl3溶液
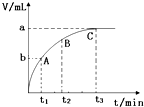
(3)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
 为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
(2)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是③(填序号).
①加热5%H2O2溶液 ②分别加入5mL5%H2O2③加入1~2 滴1mol/L FeCl3溶液
(3)某同学在50mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是C.
4.下列有关说法正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | 分子中只有共价键的物质一定是共价化合物 | |
| D. | 非金属元素不能组成离子化合物 |
1.已知可逆反应2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3是放热反应,下列说法正确的是( )
| A. | 2 mol SO2与1 mol O2能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率 | |
| B. | 2 mol SO2与1 mol O2不能完全反应生成2 mol SO3,升高温度可以加快此反应的化学反应速率 | |
| C. | 2 mol SO2与1 mol O2能完全反应生成2 mol SO3,升高温度减慢此反应的化学反应速率 | |
| D. | 2 mol SO2与1 mol O2不能完全反应生成2 mol SO3,升高温度减慢此反应的化学反应速率 |
8.下列有关说法正确的是( )
| A. | H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强 | |
| B. | Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼 | |
| C. | H2S 300℃时开始分解,H2O 1000℃时开始分解,说明O的非金属性比S强 | |
| D. | Na和Mg与酸都能激烈反应放出氢气,故无法比较它们的金属性强弱 |
18.下列说法不正确的是( )
| A. | 同族元素,随着电子层的增加,I1逐渐增大 | |
| B. | 通常情况下,电离能I1<I2<I3 | |
| C. | 同周期元素,随着核电荷数的增加,I1呈增大趋势 | |
| D. | 电离能越小,元素的金属性越强 |
5.下列关于氢硫酸、亚硫酸、硫酸的说法中正确的是 ( )
| A. | 它们都有酸性,电离出的H+有弱氧化性 | |
| B. | 它们都是酸,彼此之间不发生反应 | |
| C. | 亚硫酸易分解放出SO2,所以它是挥发性酸 | |
| D. | 在空气中放置,它们都会因氧化而变质 |
2. 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )
 白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列1mol化学键需要吸收的能量分别为:P-P a kJ、P-O b kJ、P=O c kJ、O=O d kJ.根据下图所示的分子结构和有关数据估算1mol P4发生该反应放出的热量是( )| A. | (6a+5d-4c-12b) kJ | B. | (4c+12b-6a-5d) kJ | C. | (4c+12b-4a-5d) kJ | D. | (5a+5d-4c-12b) kJ |
3. 绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )
绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )
 绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )
绿茶中含有物质EGCG具有抗癌作用,能使癌细胞自杀性死亡其结构见图.下列有关EGCG的说法中正确的是( )| A. | EGCG易被氧化 | |
| B. | EGCG的分子中有1个手性碳原子 | |
| C. | 1mol EGCG与浓溴水发生取代反应时最多消耗6molBr2 | |
| D. | 1mol EGCG与氢氧化钠溶液反应最多消耗10molNaOH |