题目内容
(1)地壳中含量最多的金属元素是 画出其原子结构示意图
(2)写出CH3COOH电离方程式
(3)下列各组化学反应中,盐酸均为反应物,其中属于氧化还原反应的是 ,利用盐酸氧化性的是 ,利用盐酸还原性的是 ,只利用盐酸酸性的是 .(用序号填写)
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O ②2HCl+2Na=2NaCl+H2↑
③2HCl+CuO=CuCl2+H2O ④HCl+HClO=Cl2↑+H2O
⑤CaCO3+2HCl=CaCl2+CO2↑+2H2O ⑥2HCl+Fe=FeCl2+H2↑
(2)写出CH3COOH电离方程式
(3)下列各组化学反应中,盐酸均为反应物,其中属于氧化还原反应的是
①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O ②2HCl+2Na=2NaCl+H2↑
③2HCl+CuO=CuCl2+H2O ④HCl+HClO=Cl2↑+H2O
⑤CaCO3+2HCl=CaCl2+CO2↑+2H2O ⑥2HCl+Fe=FeCl2+H2↑
考点:氧化还原反应,原子结构示意图,电离方程式的书写
专题:基本概念与基本理论
分析:(1)地壳中含量最多的金属元素是Al,铝原子核外有3个电子层、13个电子;
(2)醋酸是弱电解质,在水溶液里部分电离生成氢离子和醋酸根离子;
(3)有电子转移的化学反应是氧化还原反应,反应中HCl得电子化合价降低的时HCl作氧化剂、失电子化合价升高时HCl作氧化剂、HCl中各元素化合价不变时HCl体现酸性.
(2)醋酸是弱电解质,在水溶液里部分电离生成氢离子和醋酸根离子;
(3)有电子转移的化学反应是氧化还原反应,反应中HCl得电子化合价降低的时HCl作氧化剂、失电子化合价升高时HCl作氧化剂、HCl中各元素化合价不变时HCl体现酸性.
解答:
解:(1)(1)地壳中含量最多的金属元素是Al,铝原子核外有3个电子层、13个电子,其原子结构示意图为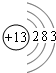 ,故答案为:Al;
,故答案为:Al; ;
;
(2)醋酸是弱电解质,在水溶液里部分电离生成氢离子和醋酸根离子,其电离方程式为CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(3)①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中部分Cl元素化合价由-1价变为0价、部分Cl元素化合价不变,所以HCl体现还原性和酸性;
②2HCl+2Na=2NaCl+H2↑中H元素化合价由+1价变为0价,所以HCl体现氧化性;
③2HCl+CuO=CuCl2+H2O中各元素化合价不变,所以HCl体现酸性;
④HCl+HClO=Cl2↑+H2O中Cl元素化合价由-1价变为0价,则HCl体现还原性;
⑤CaCO3+2HCl=CaCl2+CO2↑+2H2O中HCl中各元素化合价不变,所以HCl体现酸性;
⑥2HCl+Fe=FeCl2+H2↑中H元素化合价由+1价变为0价,所以HCl体现氧化性;
所以属于氧化还原反应的是①②④⑥,利用盐酸氧化性的是②⑥,利用盐酸还原性的是①④,只利用盐酸酸性的是③⑤,故答案为:①②④⑥;②⑥;①④;③⑤.
 ,故答案为:Al;
,故答案为:Al; ;
;(2)醋酸是弱电解质,在水溶液里部分电离生成氢离子和醋酸根离子,其电离方程式为CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
(3)①MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中部分Cl元素化合价由-1价变为0价、部分Cl元素化合价不变,所以HCl体现还原性和酸性;
②2HCl+2Na=2NaCl+H2↑中H元素化合价由+1价变为0价,所以HCl体现氧化性;
③2HCl+CuO=CuCl2+H2O中各元素化合价不变,所以HCl体现酸性;
④HCl+HClO=Cl2↑+H2O中Cl元素化合价由-1价变为0价,则HCl体现还原性;
⑤CaCO3+2HCl=CaCl2+CO2↑+2H2O中HCl中各元素化合价不变,所以HCl体现酸性;
⑥2HCl+Fe=FeCl2+H2↑中H元素化合价由+1价变为0价,所以HCl体现氧化性;
所以属于氧化还原反应的是①②④⑥,利用盐酸氧化性的是②⑥,利用盐酸还原性的是①④,只利用盐酸酸性的是③⑤,故答案为:①②④⑥;②⑥;①④;③⑤.
点评:本题考查了氧化还原反应、弱电解质的电离等知识点,根据元素化合价是否变化及化合价升降确定氧化性、还原性,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、46g有机物C2H6O中含有的H-O键的数目为NA |
| B、常温下,2L 1mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6L O2组成的混合气体中所含原子数为NA |
| D、18g D2O含有的电子总数为10NA |
某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生.反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色.试管底部出现灰绿色悬浮物.收集少量黑色粉末与稀硫酸作用有气泡产生.则下列反应没有发生的是( )
| A、FeCl3+3H2O═Fe(OH)3↓+3HCl |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、3Zn+2FeCl3═3ZnCl2+2Fe |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
在高中我们将从元素原子得失电子的角度来认识氧化还原反应,而元素原子得失电子表现为元素化合价的变化.因此可以把元素化合价有升降的化学反应确定为氧化还原反应,据此可判断下列化学反应不属于氧化还原反应的是( )
| A、Zn+CuSO4=ZnSO4+Cu | ||||
B、CuO+CO
| ||||
| C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ | ||||
D、2KClO3
|
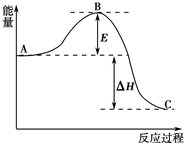 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.