题目内容
【题目】Ι.用50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液中和反应过程中所放出的热量计算中和热 。
(1)烧杯间填满泡沫塑料的作用是___________________________________;
(2)大烧杯上若不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”、“无影响”)
(3)如图所示,仪器A的名称是____________________;

(4)重复三次实验,记录的实验数据如下:
实验用品 | 溶液温度 | |||
t1 | t2 | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 25.5 ℃ |
③ | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ |
已知:Q=cmΔt,反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。计算ΔH=___________kJ/mol
(5)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、“不相等”),所求中和热______(填“相等、“不相等”).
Ⅱ.某研究性学习小组设计了一组实验来探究元素周期律。甲同学一次性完成N、C、Si的非金属性强弱的比较;乙同学完成了氧元素的非金属性比硫强的实验。

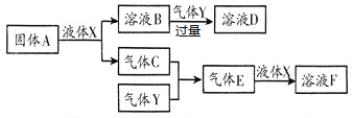
(1)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3 溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)
(2)乙同学设计的实验所用到试剂A为________;装置C中反应的化学方程式为___________________________。
【答案】 保温、隔热、减少热损失 偏小 环形玻璃搅拌棒 -56.8 不相等 相等 ① ④ H2O2 O2+2H2S=2S↓+2H2O
【解析】分析:Ι.(1)根据实验中尽可能减少热量损失分析;
(2)不盖硬纸板,会有一部分热量散失;
(3)根据仪器构造分析;
(4)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=cm△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(5)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
Ⅱ.(1)依据装置中为强酸制备弱酸依此选择试剂;
(2)通过比较单质的氧化性来判断非金属性,氧气与硫化氢反应生成硫沉淀。
详解:Ι.(1)中和热的测定实验中要尽可能减少热量损失,则烧杯间填满泡沫塑料的作用是保温、隔热、减少热损失;
(2)大烧杯上如不盖硬纸板,会使一部分热量散失,所以测得的中和热数值偏小;
(3)根据仪器构造可判断仪器A的名称是环形玻璃搅拌棒;
(4)第1次实验盐酸和NaOH溶液起始平均温度为20℃,反应后温度为23.3℃,反应前后温度差为3.3℃;第2次实验盐酸和NaOH溶液起始平均温度为20℃,反应后温度为25.5℃,反应前后温度差为:5.5℃;第3次实验盐酸和NaOH溶液起始平均温度为20℃,反应后温度为23.5℃,反应前后温度差为:3.5℃;第2组数据相差较大,舍去,2次试验的平均值为3.4℃;取50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液进行实验,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/mL=80g,温度变化的值为△T=3.4℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.4212kJ,所以实验测得的中和热△H=-(1.4212kJ/0.025mol)=-56.8kJ/mol;
(5)反应放出的热量和所用酸以及碱的量的多少有关,实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以改用实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行上述实验,测得中和热数值相等;
Ⅱ.(1)通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,所以A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液;
(2)要完成O元素的非金属性比S强的实验研究,通过比较单质的氧化性来判断非金属性,所以用二氧化锰作催化剂使双氧水分解生成氧气,即A中试剂是双氧水。氧气通过氢硫酸或硫化钠溶液会生成硫单质,其反应的方程式为:2H2S+O2=2S↓+2H2O。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案