题目内容
【题目】下列说法中正确的是( )
A. 原子最外层只有1个电子的元素一定是金属元素
B. 最外层电子数比次外层电子数多的元素一定位于第二周期
C. 氯元素的近似相对原子质量为35.5,则它在自然界中存在的两种同位素35Cl和37Cl的原子个数比为1:3
D. 金属与非金属分界线附近的元素既有金属性,又有非金属性,称为过渡元素
【答案】B
【解析】分析:A.氢元素原子最外层电子数为1,是非金属元素;B.根据核外电子排布规律分析;C.元素的相对原子质量是该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和;D.副族和第Ⅷ族元素属于过渡元素。
详解:A.原子最外层只有1个电子的元素不一定是金属元素,例如氢元素原子最外层电子数为1,是非金属元素,A错误;B.根据原子核外电子排布规律可知最外层电子不超过8个,则次外层电子也少于8,因此次外层为K层,最外层为L层,元素原子核外共两个电子层,位于第2周期,B正确;C.氯元素的近似相对原子质量为35.5,则根据十字交叉法可知它在自然界中存在的两种同位素35Cl和37Cl的原子个数比为![]() ,C错误;D.金属与非金属分界线附近的元素均是主族,过渡元素是指副族和第Ⅷ族元素组成的,过渡元素均是金属元素,D错误。答案选B。
,C错误;D.金属与非金属分界线附近的元素均是主族,过渡元素是指副族和第Ⅷ族元素组成的,过渡元素均是金属元素,D错误。答案选B。

 华东师大版一课一练系列答案
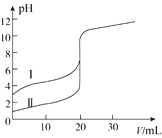
华东师大版一课一练系列答案【题目】Ι.用50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液中和反应过程中所放出的热量计算中和热 。
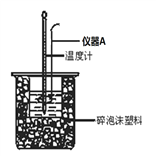
(1)烧杯间填满泡沫塑料的作用是___________________________________;
(2)大烧杯上若不盖硬纸板,求得的中和热数值______(填“偏大”、“偏小”、“无影响”)
(3)如图所示,仪器A的名称是____________________;
(4)重复三次实验,记录的实验数据如下:
实验用品 | 溶液温度 | |||
t1 | t2 | |||
① | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.3 ℃ |
② | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 25.5 ℃ |
③ | 50 mL 0.55 mol·L-1 NaOH溶液 | 50 mL 0.5 mol·L-1 HCl溶液 | 20 ℃ | 23.5 ℃ |
已知:Q=cmΔt,反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。计算ΔH=___________kJ/mol
(5)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、“不相等”),所求中和热______(填“相等、“不相等”).
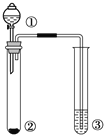
Ⅱ.某研究性学习小组设计了一组实验来探究元素周期律。甲同学一次性完成N、C、Si的非金属性强弱的比较;乙同学完成了氧元素的非金属性比硫强的实验。
(1)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸③碳酸钙④Na2SiO3 溶液⑤SiO2
试剂A为_________;试剂C为_________(填序号)
(2)乙同学设计的实验所用到试剂A为________;装置C中反应的化学方程式为___________________________。
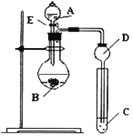
【题目】利用右图所示装置进行下列实验,能正确进行实验并得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氨水 | CaO | AlCl3溶液 | 制备氢氧化铝 | |
B | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:N>C>Si | |
D | 稀硫酸 | Na2S | Ag2SO4浊液 | Ksp(Ag2SO4)>Ksp(Ag2S) |
A. A B. B C. C D. D