题目内容
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
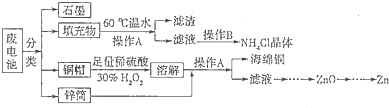
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)操作A的名称为 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式 。
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_______方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。

(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)操作A的名称为 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式 。
(5)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_______方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
(1)Zn+2OHˉ-2eˉ=Zn(OH)2
(2)温度过高氯化铵受热分解;
(3)过滤
(4)①4 ②2MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O
2MnCl2+Cl2↑+4H2O
(5)Cu+H2O2+H2SO4=CuSO4+2H2O 加热
(6)①随着pH的增大,汞的吸收率先减小后增大
②高锰酸钾在酸性条件下氧化性强
(2)温度过高氯化铵受热分解;
(3)过滤
(4)①4 ②2MnO(OH)+6HCl(浓)
 2MnCl2+Cl2↑+4H2O
2MnCl2+Cl2↑+4H2O(5)Cu+H2O2+H2SO4=CuSO4+2H2O 加热
(6)①随着pH的增大,汞的吸收率先减小后增大
②高锰酸钾在酸性条件下氧化性强
(1)负极发生氧化反应,由方程式可知Zn被氧化生成Zn(OH)2,则电极方程式为Zn+2OHˉ-2eˉ=Zn(OH)2;
(2)较高温度时,氯化铵易分解生成氯化氢和氨气,所以得不到氯化铵晶体。
(3)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O。
①该反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=1mol×2×2×(4?3)=4mol。
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:MnO(OH)+6HCl(浓) 2MnCl2+Cl2↑+4H2O。
2MnCl2+Cl2↑+4H2O。
(5)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:
Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热;
(6)①根据图象知,随着pH的增大,汞的吸收率先减小后增大;酸性条件下,高锰酸钾具有强氧化性,所以酸性条件下的高锰酸钾氧化性更强。
(2)较高温度时,氯化铵易分解生成氯化氢和氨气,所以得不到氯化铵晶体。
(3)分离不溶性固体和溶液采用过滤的方法,所以该操作名称是过滤。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O。
①该反应中,氧化剂是MnO(OH)、MnO2,还原剂是草酸,当1mol MnO2参加反应时,转移电子的物质的量=1mol×2×2×(4?3)=4mol。
②MnO(OH)与浓盐酸在加热条件下也可发生反应生成氯化锰、氯气和水,反应方程式为:MnO(OH)+6HCl(浓)
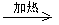 2MnCl2+Cl2↑+4H2O。
2MnCl2+Cl2↑+4H2O。(5)酸性条件下,双氧水能将铜氧化生成铜离子反应的化学方程式为:
Cu+H2O2+H2SO4=CuSO4+2H2O;加热条件下,双氧水易分解生成水和氧气,所以除去双氧水的方法是加热;
(6)①根据图象知,随着pH的增大,汞的吸收率先减小后增大;酸性条件下,高锰酸钾具有强氧化性,所以酸性条件下的高锰酸钾氧化性更强。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 Cu2++
Cu2++ CuCl+Cl- K=2.32
CuCl+Cl- K=2.32



 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。 FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。

 (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)