题目内容
分废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:

(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,转化反应式如下:
PbSO4(s)+CO (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
①下列说法错误的是:___________________。
A.PbSO4的Ksp比PbCO3的Ksp大
B.该反应平衡时,c(CO )=c(SO42-)
)=c(SO42-)
C.该反应的平衡常数K=
②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在_________溶液中PbSO4转化率较大,理由是_________。
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是______________。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的SO过,循环利用时可能出现的问题是__________________。
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入__________mL的0.5 mol·L-1 Na2SO3溶液。

(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,转化反应式如下:
PbSO4(s)+CO
 (aq)
(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)①下列说法错误的是:___________________。
A.PbSO4的Ksp比PbCO3的Ksp大
B.该反应平衡时,c(CO
 )=c(SO42-)
)=c(SO42-)C.该反应的平衡常数K=

②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在_________溶液中PbSO4转化率较大,理由是_________。
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是______________。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的SO过,循环利用时可能出现的问题是__________________。
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入__________mL的0.5 mol·L-1 Na2SO3溶液。
(1) ①B(2分) ②Na2CO3(1分);相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大 (1分)
(2)蒸发浓缩(1分)、冷却结晶(1分) 取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42- (2分)
(3)HNO3(1分)浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)4 PbSO4 + 6OH- ="3" PbO·PbSO4·H2O + 3 SO42- + 2 H2O (2分)
(5) 60(2分)
(2)蒸发浓缩(1分)、冷却结晶(1分) 取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42- (2分)
(3)HNO3(1分)浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)4 PbSO4 + 6OH- ="3" PbO·PbSO4·H2O + 3 SO42- + 2 H2O (2分)
(5) 60(2分)
试题分析:(1) ①对于PbSO4(s)+CO
 (aq)
(aq) PbCO3(s)+SO42-(aq)可知:
PbCO3(s)+SO42-(aq)可知:反应的平衡常数
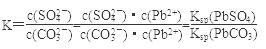
根据转化关系可知PbSO4的Ksp比PbCO3的Ksp大,A正确;当K=1,平衡时才有c(CO
 )=c(SO42-),B不正确;C正确。
)=c(SO42-),B不正确;C正确。②室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,前者c(CO32-)较大, PbSO4转化率较大。
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有干燥蒸发浓缩、冷却结晶、过滤、洗涤;检验该晶体中SO42-的实验方法是取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42-。
(3)可循环使用的物质HNO3;若HNO3中残留的SO42-过多,循环利用时可能出现的问题是浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(5)由于:Na2SO3+PbO2===PbO+ Na2SO4可知:n(Na2SO3)=n(PbO2)=
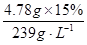 =0.03mol,故需要加入60mL的0.5 mol·L-1 Na2SO3溶液。
=0.03mol,故需要加入60mL的0.5 mol·L-1 Na2SO3溶液。
练习册系列答案
相关题目
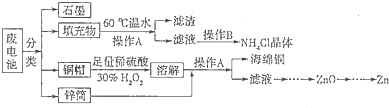



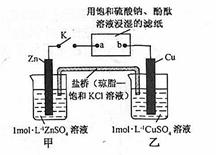
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。