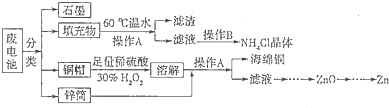
题目内容
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图。下列说法正确的是


| A.镁作Y电极 |
| B.电池工作时,Na+向负极移动 |
| C.废液的pH大于NaClO溶液的pH |
| D.X电极上发生的反应为ClO-+2H2O-4e-===ClO3-+4H+ |
A
由图中OH-向负极移动,那么Y为负极,故镁作Y电极,正确;电池工作时
Na+向正极移动,B错;Y电极发生的反应ClO-+4OH--4e-===ClO3-+2H2O,废液的pH小于NaClO溶液的pH,故C、D错误。
Na+向正极移动,B错;Y电极发生的反应ClO-+4OH--4e-===ClO3-+2H2O,废液的pH小于NaClO溶液的pH,故C、D错误。

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目




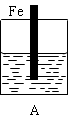
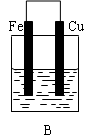
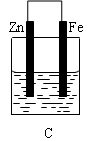
 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题: 2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。
2Ni(OH)2,根据此反应式判断,此电池放电时,正极上发生反应的物质是( )。