题目内容
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属于 区元素,它的外围电子的电子排布图为 。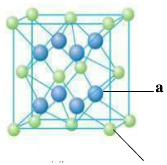
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
(1) 第三周期ⅥA族(1分)p(1分) 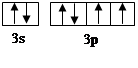 (1分)
(1分)
(2)V形(1分)sp型杂化(1分) SO2(2分) SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大。(2分)
(3)紫2分电子由较高能级跃迁到较低能级时,以光的形式释放能量。(2分)
(4)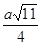 (2分)
(2分)
解析试题分析:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,应为C元素,Z是地壳内含量最高的元素,为O元素,M的内层电子数是最外层电子数的9倍,为Ca元素,N的原子序数比M小1,为K元素, Q在元素周期表的各元素中电负性最大,应为F元素。(1)由以上分析可知,X为S,在周期表的位置是第三周期ⅥA族,属于p区元素;(2)XZ2分子是SO2中,S和O形成2个δ键,有1个孤电子对,为V形,YZ2分子是CO2,C和O形成2个δ键,没有孤电子对,为直线形,sp型杂化;(3)N为K,焰色反应为紫色,电子由较高能级跃迁到较低能级时,以光的形式释放能量,所以呈现不同的焰色;4)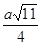
考点:考查物质结构与性质、晶包的计算。

用
| A.质子数、 | B.中子数、 | C.最外层电子数、 | D.电子层数填写下列空格。 |
(2)元素种类由________决定。
(3)元素有无同位素由________决定。
(4)1~18号元素的化合价主要由________决定。
(5)元素的化学性质由________决定。
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
| B | D | |
| | | E |
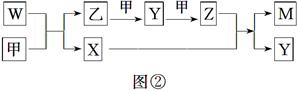
请回答下列问题:
(1)Z的化学式为__________________。
(2)E的单质与水反应的离子方程式为________________________________________。
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W空气燃料电池放电时,正极反应式为________________________________,负极反应式为____________________。
(4)将一定量的A2、B2的混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为________,该温度下的平衡常数为____________(结果保留3位有效数字)。
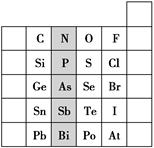
下表列出了A~R十种元素在周期表中的位置:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | | | | E | R | F | |
| 3 | A | C | D | H | | I | G |
| 4 | B | | | | | | |
请回答下列问题:
(1)写出R单质分子的电子式________。
(2)A、C、D三种元素的最高价氧化物对应的水化物中碱性最强的是________(填化学式)。
(3)A、B、C三种元素的阳离子按离子半径由大到小的顺序排列为________(用元素的离子符号表示)。
(4)写出A的单质与水反应的化学方程式_____________________________。
(5)X元素是A~R十种元素中的一种,X的原子核里有14个中子,2.7 g X在氧气里燃烧时,质量增加2.4 g。X的氢氧化物既能与氢氧化钠溶液反应,也能与盐酸反应。X的元素符号是________,它位于元素周期表中第________周期第________族。
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。
 B(在水溶液中进行)
B(在水溶液中进行)