题目内容
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是常见的非金属元素,主要以钠盐的形式存在于海水中。
(1)Y在元素周期表中的位置是________;X氢化物的电子式为_________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈_______(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是________。
(3)Y-Ag2O电池是应用广泛的鱼雷电池,其原理如下图所示。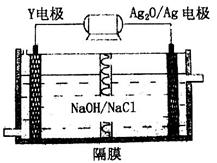
该电池的负极反应式是________。
(4)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是_________
(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
(1)第三周期第ⅢA族(1分);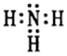 (1分)
(1分)
(2)酸(1分);NH4++H2O NH3·H2O+H+(1分,写成“=”不得分)
NH3·H2O+H+(1分,写成“=”不得分)
(3)Al+4OH--3e-=[Al(OH)4]-(2分)
(4)Si(1分);bcd(2分,全对得2分,有错不得分,选不全得1分)
解析试题分析:短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性,则X是氮元素;Y在元素周期表中所处的周期序数与族序数相等,且原子序数大于氮元素的,所以Y应该是第三周期的铝元素;Z单质是将太阳能转化为电能的常用材料,则Z是硅元素;W是常见的非金属元素,主要以钠盐的形式存在于海水中,则在短周期元素中符合条件的应该是氯元素。
(1)铝是13号元素,在元素周期表中的位置是第三周期第ⅢA族;氮元素是活泼的非金属元素,与氢元素形成极性键,因此其氢化物的电子式为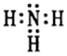 。
。
(2)氮元素的氢化物是氨气,氯元素的氢化物是氯化氢。氨水与盐酸反应生成氯化铵,NH4+水解溶液呈酸性,反应的离子方程式可表示为NH4++H2O NH3·H2O+H+。
NH3·H2O+H+。
(3)原电池中较活泼的金属做负极,失去电子,发生氧化反应。铝的金属性强于银,铝是负极,失去电子。由于电解质溶液显碱性,所以负极电极反应式为Al+4OH--3e-=[Al(OH)4]-。
(4)同周期自左向右非金属性逐渐减弱,所以Z和W比较,非金属性较弱的是Si。A、地壳中元素的含量高低与元素的非金属性强弱无关,a不正确;b、非金属性越强,最高价氧化物对应水化物的酸性越强,因此最高价氧化物对应水化物的酸性强弱可以作为判断依据,b正确;c、非金属性越强,与氢元素形成的共价键越强,断键时需要的能量就越高。所以断开氢化物中1mol H—Z或H—W键所需的能量可以作为判断依据,c正确;d、非金属性越强,在形成的共价键中共用电子对就偏向该元素,从而显电性。所以Z与W以共价键形成化合物时,Z或W显示的电性可以作为判断依据,d正确,答案选bcd。
考点:考查元素周期表的结构、元素周期律的应用、电子式、盐类水解、非金属性强弱比较

 天天向上口算本系列答案
天天向上口算本系列答案回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。
A、B、C、X、Y、Z元素的原子序数依次增大,根据信息完成问题:
| 元素A | 各能级上的电子数相等 |
| 元素C | 某种核素原子的质量数为18,中子数为10 |
| 元素X | 单质是良好的半导体材料 |
| 元素Y | 其单质为淡黄色晶体,常用来处理打碎的水银温度计 |
| 元素Z | 3d能级上有4个未成对电子 |
(1)Z元素在周期表中的位置 ,其电子排布式 。
(2)AO2的熔点远低于XO2熔点的主要原因是 。
(3)X的氧化物和NaOH溶液反应的化学方程式 。
(4)B、C气态基态原子的第一电离能的大小关系为 。
(5)请用离子方程式表达Na2Y溶液呈碱性的原因 。
(6)已知CH3COOH(aq)
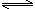 H+(aq)+CH3COO—(aq) △H=+akJ/mol
H+(aq)+CH3COO—(aq) △H=+akJ/molCH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) △H=—bkJ/mol
则中和热的△H= kJ/mol
以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中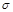 键与 键与 数目比为1:2 数目比为1:2 |
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (填离子符号)。
(3)H?X与H?Y两种共价键中,键的极性较强的是 ,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是 (填元素符号);Y的常见氢化物易液化的主要原因是 。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是 。
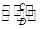 B(在水溶液中进行)
B(在水溶液中进行) ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。