题目内容
A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA3型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。据此回答下列问题:
(1)D元素在元素周期表中的位置是 。
(2)B与D所形成的化合物电子式为 。
(3)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,产生淡黄色沉淀,其反应的化学方程式为 。
(4)实验室里除去BA2气体,可用下列试剂中的 (填字母)。
A.酸性高锰酸钾溶液 B.浓硫酸
C.NaOH溶液 D.品红溶液
(5)由A、B、D三种元素所组成的某种盐水溶液显碱性,其原因是 (用离子方程式表示)。
(1)第四周期第ⅠA族
(2)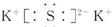
(3)K2S+Cl2=2KCl+S↓ (4)A、C
(5)SO32-+H2O HSO3-+OH-
HSO3-+OH-
解析

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
用
| A.质子数、 | B.中子数、 | C.最外层电子数、 | D.电子层数填写下列空格。 |
(2)元素种类由________决定。
(3)元素有无同位素由________决定。
(4)1~18号元素的化合价主要由________决定。
(5)元素的化学性质由________决定。
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。

 ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。

