题目内容
5.X、Y为同主族元素,Y的原子半径大于X.下列说法正确的是(m、n均为正整数)( )| A. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| B. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| C. | 若HnY为气态,则HnX的熔、沸点一定比HnY低 | |
| D. | 若Y的最高正价为+7,则X的最高正价一定为+7 |
分析 A.同主族自上而下金属性增强,最高价氧化物对应水化物的碱性增强;
B.若HnXOm为强酸,利用硝酸来分析;
C、利用氢键来分析氢化物的熔、沸点;
D.若Y的最高正价为+7,则为ⅥⅠA族元素,利用F元素来分析.
解答 解:A.若X(OH)n为强碱,X、Y为同主族金属元素,Y的原子半径大于X,金属性Y>X,则Y(OH)n也一定为强碱,故A正确;
B.HnXOm为强酸,若该酸为硝酸,则氨气溶于水溶液显碱性,故B错误;
C、X、Y为同主族元素,Y的原子半径大于X,若HnY为气态,HnX若为HF、H2O、NH3,由于氢键的存在HnX的熔、沸点一定比HnY高,故C错误;
D.若Y的最高正价为+7,则X、Y为ⅥⅠA族的同主族元素,若X为F元素,则F没有正化合价,故D错误;
故选A.
点评 本题考查学生利用同族元素性质的递变规律来分析解答,学生应熟悉常见的物质及物质的性质是解答本题的关键,注意特例的应用来分析问题.

练习册系列答案
相关题目
15.氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,该反应可写成NH4H+H2O=NH3•H2O+H2↑.下列说法错误的是( )
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水形成的溶液呈碱性 | |
| C. | NH4H与水反应时,NH4H是氧化剂 | |
| D. | NH4H固体投入少量水中,可能有两种气体产生 |
16.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).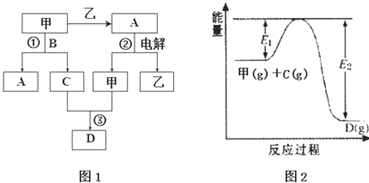
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
①若方程式系数为最简整数比,则该温度下的平衡常数K=20;填写表中空格:②v正<v逆 ③v正>v逆.

请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n(D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
20.羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与C02相似,高温下分解为CO和S.下列有关说法正确的是( )
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、C02、CO、S晶体类型相同 | |
| D. | 22.4LOCS中约含有3×6.02×1023个原子 |
10.常温下,下列溶液中的离子浓度关系一定正确的是( )
| A. | PH=11的Na2SO3溶液中,水的电离c( H+)=1.0×10-11mol/L | |
| B. | PH=10的某BOH的碱溶液中加水稀释至100倍,稀释后的溶液中c( OH-)=1.0×10-6mol/L | |
| C. | PH=4的NaHC2O4溶液中存在:c( Na+)>c(HC2O4-)>c( H+)>c(C2O42-)>c( OH-) | |
| D. | PH=2的硝酸与PH=12的氨水等体积混合c( NO3-)>c( NH4+)>c( H+)>c( OH-) |
17.下列化合物中,属于原子晶体的是( )
| A. | CO2 | B. | NaOH | C. | SiO2 | D. | Si |
14.下列说法中,错误的是( )
| A. | 化学反应必然伴随着能量的变化 | |
| B. | 能量变化是化学反应的基本特征之一 | |
| C. | 化学变化的能量变化主要是由化学键的变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物的状态和物质的量无关 |
15.一位患者镶了两颗假牙,其中一颗是黄金的,另一颗是不锈钢的.自镶上假牙后,他时感头疼,心情烦躁,多次治疗未见好转.如果你是医生,下列方法不能治疗其疾病的是( )
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |

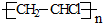 、I:
、I: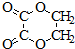 .
.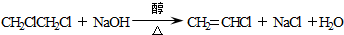 ;
;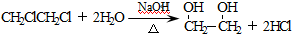 .
.