题目内容
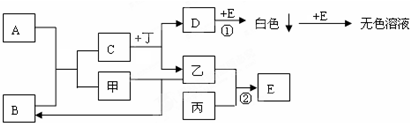
16.A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,甲、乙则是两种单质,以上单质和化合物之间在如图1所示的反应关系(反应物和生成物均无省略).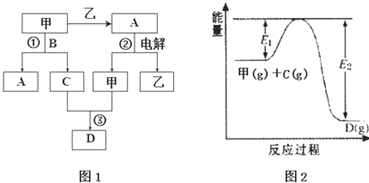
请回答下列问题:
(1)图1所示转化过程中包含的反应类型有cd(填字母).
a.置换反应 b.复分解反应c.分解反应 d.化合反应
(2)图1中反应①的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图1中反应③在一定条件下为可逆反应,反应的能量变化如图2所示,当该反应处 于平衡状态时,下列措施中有利于提高C的平衡转化率的是BC(填字母).
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.增加C的量
(4)若将l.00mol甲和2.00mol C混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,用甲表示的化学反应速率为0.075mol•L-1•min-1.
(5)容积均为2L的四个密闭容器中均进行着(4)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 | n(甲) | n(C) | n(D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
分析 (1)(2)A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,则D为NO2,甲、乙是两种单质,甲和乙反应生成A,电解A生成甲和乙,且C能和甲反应生成二氧化氮,反应①②均是工业生产中的重要反应,故甲为O2,乙是Al,A是Al2O3,氧气和B反应生成E和C,C和氧气反应生成二氧化氮,所以C是NO,B是NH3;
(3)反应③为:2NO+O2?2NO2 ,根据图2知,该反应是放热反应,提高一氧化氮的转化率,可以采取的措施有:降低温度、增大压强、增大氧气的量、减少二氧化氮的量等;
(4)根据2NO+O2?2NO2 可知,反应后气体物质的量减少的量等于参加反应的氧气的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算用氧气表示的化学反应速率;
(5)反应(3)中的反应为:2NO+O2?2NO2 ,I处于平衡状态,根据K=$\frac{{c}^{2}(N{O}_{2})}{c{\;}^{2}(NO)•c(O{\;}_{2})}$计算平衡常数,计算II、Ⅲ中浓度熵Qc,与平衡常数比较判断反应进行方向,进而判断v正、v逆的相对大小.
解答 解:A、B、C、D都是中学化学中的常见化合物,均由周期表前18号元素组成,D为红综色气体,则D为NO2,甲、乙是两种单质,甲和乙反应生成A,电解A生成甲和乙,且C能和甲反应生成二氧化氮,反应①②均是工业生产中的重要反应,故甲为O2,乙是Al,A是Al2O3,氧气和B反应生成E和C,C和氧气反应生成二氧化氮,所以C是NO,B是NH3,
(1)甲和乙发生化合反应,电解A是氧气和水属于分解反应,该反应中没有复分解反应和置换反应,故选:cd;
(2)反应①的化学方程式是:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应③为:2NO+O2?2NO2 ,根据图2知,该反应是放热反应,则反应方程式为:2NO+O2?2NO2 △H<0,提高一氧化氮的转化率,可以采取的措施有:降低温度、增大压强、增大氧气的量、减少二氧化氮的量,而使用催化剂,加快反应速率,不影响平衡移动,加入NO,平衡向正反应方向移动,但NO的转化率降低,故选:BC;
(4)若将1 molO2和2mol NO混合充入容积为2L的密闭容器中,3分钟后反应达到平衡.平衡后混合气体总物质的量为2.55mol,根据2NO+O2?2NO2 可知,反应后气体物质的量减少的量等于参加反应的氧气的量,故参加反应氧气为1mol+2mol-2.55mol=0.45mol,则用氧气表示的化学反应速率=$\frac{\frac{0.45mol}{2L}}{3min}$=0.075 mol/(L•min),
故答案为:0.075;
(5)反应(3)中的反应为:2NO+O2?2NO2 ,I处于平衡状态,故该温度下的平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c{\;}^{2}(NO)•c(O{\;}_{2})}$=$\frac{(\frac{0.2}{2})^{2}}{({\frac{0.1}{2})}^{2}(\frac{0.2}{2})}$=20,
II中反应的浓度熵Qc=$\frac{({\frac{1}{2})}^{2}}{({\frac{0.4}{2})}^{2}(\frac{0.1}{2})}$=125>20,反应向逆反应进行,故v正<v逆,
Ⅲ中反应的浓度熵Qc=$\frac{({\frac{0.8}{2})}^{2}}{(\frac{1.2}{2})^{2}(\frac{0.6}{2})}$=$\frac{4}{27}$<20,反应向正反应进行,故v正>v逆,
故答案为:20;v正<v逆;v正>v逆.
点评 本题考查无机物推断、化学反应速率计算、化学平衡影响因素、化学平衡常数计算、反应热计算,侧重考查学生对知识迁移运用,需要学生具备知识的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 红外光谱 | B. | 核磁共振氢谱 | C. | 燃烧法 | D. | 与钠反应 |
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101 kPa,1molNa在O2中完全燃烧放出255.5KJ的热量 |
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(2)B的最简单气态氢化物分子空间构型三角锥形;其沸点高于同主族的其它气态氢化物原因NH3分子间能形成氢键;
(3)D的最高价氧化物对应水化物的化学键类型离子键、共价键;
(4)B、C、D、E简单离子半径大小S2->N3->O2->Na+(用元素符号表示);
(5)由A、B、C与H元素组成的一种常见的酸式盐与过量的D的最高价氧化物对应的水化物反应的离子方程式NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O,在25℃,101kPa下,2gE单质在C2气体中完全燃烧后恢复到原状态,放热18.72kJ,该反应的热化学方程式S(s)+O2(g)=SO2(g)△H=-299.52kJ/mol.
| A. | 丙醛 | B. | 甲酸乙酯 | C. | 乙酸甲酯 | D. | 丙烯酸 |
| A. | 1:4 | B. | 4:1 | C. | 2:1 | D. | 1:2 |
| A. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| B. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| C. | 若HnY为气态,则HnX的熔、沸点一定比HnY低 | |
| D. | 若Y的最高正价为+7,则X的最高正价一定为+7 |