题目内容
2.在密闭容器中,使2mol N2和6mol H2混合发生下列反应:N2(g)+3H2(g)?2ΝΗ3(g)△H<0(1)当反应达到平衡时,N2和H2的浓度比是1:3;N2和H2的转化率比是1:1.
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变小,密度不变.(填“变大”、“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将逆向(填“正向”、“逆向”或“不”)移动.
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将向左移动(填“向左移动”、“向右移动”或“不移动”).达到新平衡后,容器内温度小于(填“大于”、“小于”或“等于”)原来的2倍.
分析 (1)根据开始时注入1mol N2和3mol H2,发生反应时消耗氮气和氢气始终按照1:3进行,所以当反应达到平衡时,剩余N2和H2的浓度比是仍然为1:3;根据转化率=$\frac{消耗量}{起始量}$判断N2和H2的转化率比;
(2)根据升高平衡体系的温度时,平衡向逆反应方向移动,根据混合气体的平均相对分子质量=$\frac{m}{n}$,密度=$\frac{m}{V}$判断;
(3)恒压容器中加入惰气,为保持压强不变,容器体积增大,减小压强,平衡向气体体积增大的方向移动;
(4)运用勒夏特列原理解答,若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,升温平衡向吸热的逆向移动.
解答 解:(1)因为开始时注入1mol N2和3mol H2,发生反应时消耗氮气和氢气始终按照1:3进行,所以当反应达到平衡时,剩余N2和H2的浓度比是仍然为1:3;又转化率=$\frac{消耗量}{起始量}$,所以N2和H2的转化率比为1:1;
故答案为:1:3;1:1;
(2)因为该反应为放热反应,则升高平衡体系的温度时,平衡向逆反应方向移动,气体物质的量变大,质量不变,所以混合气体的平均相对分子质量=$\frac{m}{n}$将减小,又容器体积不变,所以密度=$\frac{m}{V}$也不变;
故答案为:变小;不变;
(3)当达到平衡时,充入氩气,并保持压强不变,体积增大,体系的压强减小平衡向气体体积增大的方向进行,反应是气体体积减小的反应,所以平衡逆向进行;
故答案为:逆向;
容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,升温平衡向吸热的逆向移动,使体系温度降低,反应是放热反应,所以平衡向左移动,达到新平衡后,容器内温度下雨原来的2倍;
故答案为:向左移动;小于.
点评 本题考查了化学平衡计算分析,影响化学平衡的因素分析判断,反应特征和平衡移动原理是解题关键,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 氨水和液氨不同,氨水是混合物,液氨是纯净物 | |
| B. | 氨水中物质的量浓度最大的粒子是NH3•H2O(除水) | |
| C. | 氨水显弱碱性,故通常保存在金属容器中 | |
| D. | 在1 mol•L-1氨水中,NH3•H2O、NH${\;}_{4}^{+}$、NH3的物质的量浓度之和为1 mol•L-1 |
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2 | |
| B. | 向盐酸中滴加氨水:H++OH-=H2O | |
| C. | 向KI溶液中通入少量Cl2:Cl2+2I-=2Cl-+I2 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO4 2-=CaSO4↓+H2O |
| A. | XYZ2 | B. | X2YZ3 | C. | X2YZ2 | D. | XYZ3 |
| A. | CO2不是大气污染物,所以可以大量排放到空气中 | |
| B. | 以无磷洗涤剂代替含磷洗涤剂 | |
| C. | 实验后的有毒有害物质应分类收集,统一处理 | |
| D. | 在通风橱中制取氯气时不用NaOH溶液吸收尾气 |
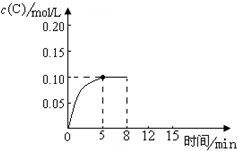 在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示 的分子式为C12H16O.
的分子式为C12H16O. 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇.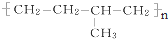 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2.