题目内容
7.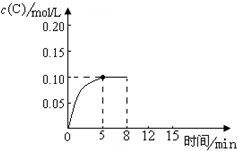 在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示
在500℃时,将足量的A固体投入2.0L真空密闭容器中,发生A(s)═2B(g)+C(g)反应,测得气体C随时间的浓度变化如图所示(1)已知该反应只有高温下能自发进行,则该反应的△H>0(填“>”、“<”或“=”).
(2)在上述反应条件下,从反应开始到平衡,用V(B)=0.04mol•L-1•min-1,500℃时的平衡常数K=4×10-3;
(3)在反应温度和容器体积不变的条件下,下列能说明上述反应达到平衡状态的是AC
A.混合气体的压强保持不变
B.气体C的体积分数保持不变
C.混合气体的密度保持不变
D.B的正反应速率等于C的逆反应速率
(4)在500℃时,上述反应达到平衡后,在8min时将容器体积迅速压缩为1.0L,反应在12min建立新的平衡,画出8~15min内C气体物质的量浓度随时间变化的示意图.
分析 (1)反应自发进行的判断依据是△H-T△S<0,据此分析判断,该反应只有高温下能自发进行△H>0;
(2)分析图象,结合化学平衡三段式列式计算平衡浓度,反应速率V=$\frac{△c}{△t}$,
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
(3)恒温条件下,在固定容积的密闭容器里发生A(s)═2B(g)+C(g)反应,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(4)第8min末将容器的体积缩小一半,瞬间C的浓度变为原来的2倍,压强增大,平衡向逆反应移动,12min末达到新的平衡,此时C浓度约为0.1mol/L,据此作图.
解答 解:(1)反应自发进行的判断依据是△H-T△S<0,该反应只有高温下能自发进行说明△S>0,△H>0;
故答案为:>;
(2)分析图象,结合化学平衡三段式列式计算平衡浓度,C的平衡浓度为0.10mol/L
A(s)═2B(g)+C(g)
起始量(mol/L)
变化量(mol/L) 0.2 0.1
平衡量(mol/L) 0.2 0.1
从反应开始到平衡,用B计算的反应速率V(B)=$\frac{△c}{△t}$=$\frac{0.2mol/L}{5min}$=0.04mol/L•min,
平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=c2(B)c(C)=0.22×0.1=4×10-3;
故答案为:0.04;4×10-3;
(3)恒温条件下,在固定容积的密闭容器里发生A(s)═2B(g)+C(g)反应,当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,反应是气体体积增大的反应,A(s)═2B(g)+C(g);
A.反应前后气体物质的量变化,混合气体的压强保持不变说明反应达到平衡状态,故A符合;
B.A为固体,所以气体CB的体积含量始终不变,气体C的体积分数保持不变不能说明反应达到平衡状态,故B不符合;
C.反应前后气体质量变化,容器体积不变,混合气体的密度保持不变能说明反应大大的平衡状态,故C符合;
D.V(B)正=2V(C)逆,说明正逆反应速率相同,B的正反应速率等于C的逆反应速率不能说明反应达到平衡状态,故D不符合;
故答案为:AC;
(4)第8min末将容器的体积缩小一半,瞬间C的浓度变为原来的2倍,压强增大,平衡向逆反应移动,12min末达到新的平衡,达到和原来相同的耦合状态,所以此时C浓度为0.1mol/L,据此作图为: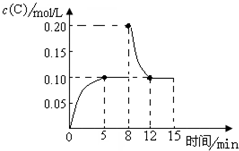 ;
;
故答案为: .
.
点评 本题考查了化学平衡的分析应用,主要是反应速率影响因素、平衡常数计算,图象分析绘制的依据和方法,化学平衡移动原理的理解应用是解题关键,题目难度中等.

| A. | 使甲基橙变红色的溶液:Mg2+、Fe2+、SO42-、NO3- | |
| B. | 弱碱性溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 使石蕊显紫色的溶液:Al3+、K+、SO42-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |
| 选项 | A | B | C | D |
| 装置 |  | 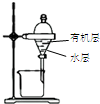 有机层水层 | 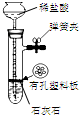 | 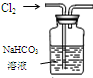 |
| 目的 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 制取少量CO2气体 | 除去Cl2中含有的少量HCl |
| A. | A | B. | B | C. | C | D. | D |
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | ① | B. | ①②⑤ | C. | 只有③④ | D. | ①②③④⑤ |
| A. | 含共价键的共价化合物一定是分子晶体,分子晶体一定含共价键 | |
| B. | 固态可以导电的是离子晶体和金属晶体 | |
| C. | 由原子构成的晶体一定是原子晶体,由分子构成的晶体一定是分子晶体 | |
| D. | 判定晶体为离子晶体还是分子晶体的方法是看其熔融态是否能导电 |

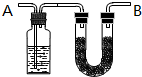 将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108.
将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108. .
.