题目内容
14.X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )| A. | XYZ2 | B. | X2YZ3 | C. | X2YZ2 | D. | XYZ3 |
分析 X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,结合化合价规则与常见物质化学式进行判断.
解答 解:X原子最外层电子排布为ns1,处于第ⅠA族,化合价为+1,Y原子最外层电子排布为3s23p1,则Y为Al元素,Z原子最外层电子排布为2s22p4,则Z为氧元素,化合价为-2,
A.XYZ2中Y的化合价为+3价,符合,如NaAlO2,故A正确;
B.X2YZ3中Y的化合价为+4价,不符合,故B错误;
C.X2YZ2中Y的化合价为+2价,不符合,故C错误;
D.XYZ3中Y的化合价为+5价,不符合,故D错误;
故选A.
点评 本题考查元素推断题,考查角度为根据原子核外电子排布特点推断元素种类,并判断可能的化合物,注意Al的最高化合价为+3价,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
3.已知常温下,浓度均为0.1mol•L-1的5种钠盐溶液pH如表:
下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
| A. | 少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++Cl-+SO42- | |
| B. | 常温下,稀释CH3COOH或HClO溶液时,溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$不变(HR代表CH3COOH或HClO) | |
| C. | 等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-) | |
| D. | 含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)-c(H+)=c(H2CO3)+c(CH3COOH) |
4.在过氧化钾与水的反应中,其还原产物和氧化产物质量比为( )
| A. | 7:2 | B. | 4:7 | C. | 7:4 | D. | 9:8 |
6.下面是同周期元素原子的价电子排布式,第一电离能最小的原子可能是( )
| A. | ns2np3 | B. | ns2np5 | C. | ns2np4 | D. | ns2np6 |
3.实验室可用如图所示装置制取的气体是( )
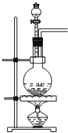

| A. | Cl2 | B. | C2H4 | C. | C2H2 | D. | CO2 |
4.表列出了前20号元素中的某些元素性质的有关数据:
(1)用元素符号标出它们在元素周期表中的对应位置:
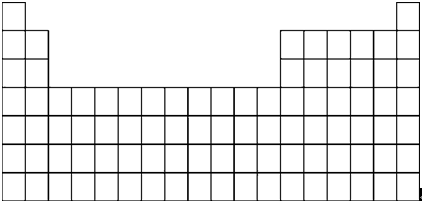
(2)在上面的元素周期表中,用斜线标出通常寻找催化剂材料的区域
(3)以上10种元素的原子中,最容易失去电子的是K(填元素符号);与H2最容易化合的非金属单质是氟气(写物质名称).
(4)用电子式表示元素③形成的氢化物过程
(5)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式CCl4或PCl3.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第VIA族.
(6)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |

(2)在上面的元素周期表中,用斜线标出通常寻找催化剂材料的区域
(3)以上10种元素的原子中,最容易失去电子的是K(填元素符号);与H2最容易化合的非金属单质是氟气(写物质名称).
(4)用电子式表示元素③形成的氢化物过程

(5)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式CCl4或PCl3.某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第VIA族.
(6)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式.