题目内容
4.如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示中,正确的是( )
| A. | 金刚石比石墨稳定性好 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| D. | 断裂1 mol石墨中的化学键吸收的能量比断裂1 mol金刚石中的化学键吸收的能量小1.9 kJ |
分析 先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,
A.金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故A错误;
B.石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C.因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故C正确;
D.依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量大于1.9 kJ,故D错误.
故选C.
点评 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.

练习册系列答案
相关题目
14.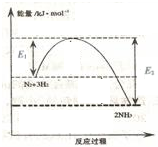 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
①前20min内,H2的反应速率为1.2×10-3mol/(L.min).
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.(1)如图表示一定温度和压强下氨气和氢气合成氨反应过程中的能量变化,则合成氨反应为放热(填“吸热”或“放热”)反应.
(2)在一定温度下,在2L密闭容器中加入催化剂并通入0.1molNH3(g),发生反应:2NH3?N2+3H2,不同时间产生N2的物质的量见下表:
| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
②达到平衡后,容器中c(NH3)═0.01mol/L.
③若在1L密闭容器中加入催化剂并通入0.1mol NH3(g),则容器中的反应速率比原容器的快(填“快”或“慢”).
9.最新科技报道,美国夏威夷联合天文中心的科学家发现了新型氢粒子,这种氢粒子是由3个氢原子核(只含质子)和2个电子构成的.对于这种粒子,下列说法中正确的是( )
| A. | 是氢的一种新的同素异形体 | B. | 3g该新型氢粒子含电子2NA | ||
| C. | 是氢的一种新的同位素 | D. | 它的组成可用H3表示 |
14.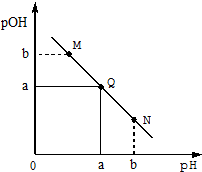 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
说法错误的是( )
 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列说法错误的是( )
| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,试回答:
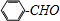 ;
; ;②
;②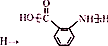 :
: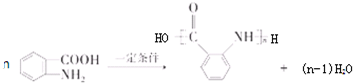 ;
;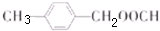 ;
;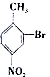 合成
合成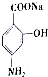 的转化流程图(写出反应物和反应条件).
的转化流程图(写出反应物和反应条件).