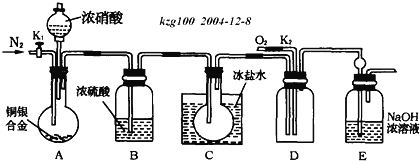
题目内容
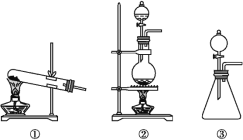
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
(1)从①、②、③装置中选择合适的制氯气装置(A处)______(填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是________________;说明该装置存在明显的缺陷,请提出合理的改进方法:________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,反应的离子方程式为_____,然后检验反应后溶液中是否含有S![]() 。检验S
。检验S![]() 的方法是:取少量反应后的溶液于试管中,先加入足量的________________至无明显现象,然后再加入少量____溶液,有白色沉淀生成,说明含有S
的方法是:取少量反应后的溶液于试管中,先加入足量的________________至无明显现象,然后再加入少量____溶液,有白色沉淀生成,说明含有S![]() 。
。
【答案】② 产生的氯气中含有水蒸气,会反应生成次氯酸 在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置) Cl2+S![]() +H2OS
+H2OS![]() +2Cl-+2H+ 稀盐酸(或HCl溶液) BaCl2(或其他合理答案)
+2Cl-+2H+ 稀盐酸(或HCl溶液) BaCl2(或其他合理答案)
【解析】
根据反应方程式得出液体和液体需要加热反应,氯气中含有水蒸气,因此B、C装置内的有色布条都会褪色,主要是氯气与水反应生成了次氯酸,因此在A、B间增加一个除水蒸气的装置,氯气具有氧化性,将Na2SO3氧化变为Na2SO4。
(1)由NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O可知,反应有液体参加,需要加热,所以选装置②;故答案为:②。
Na2SO4+Cl2↑+H2O可知,反应有液体参加,需要加热,所以选装置②;故答案为:②。
(2)装置B中干燥的有色布条褪色,说明氯气中可能混有少量的水蒸气,氯气与水反应生成次氯酸而漂白,因此应在A和B之间增加盛有浓H2SO4的洗气瓶,除去Cl2中的水蒸气;故答案为:产生的氯气中含有水蒸气,会反应生成次氯酸;在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置)。
(3)氯气把亚硫酸钠氧化为硫酸钠,自身被还原为Cl,反应的离子方程式为Cl2+ SO32+H2O SO42+2Cl+2H+,检验硫酸根必须排除其他离子的干扰,因此检验反应后溶液中含有SO42的方法是:取少量反应后的溶液于试管中,先加入足量的稀盐酸至无明显现象,然后再加入少量BaCl2溶液有白色沉淀生成,说明含有SO42;故答案为:Cl2+ SO32+H2O SO42+2Cl+2H+;稀盐酸(或HCl溶液);BaCl2(或其他合理答案)。

【题目】(1)水溶液中的离子平衡是中学化学中重要知识。
①常温下,0.001mol/LNaOH溶液的pH=____;
②(NH4)2SO4是一种重要的氮肥,长期施用会使土壤酸化,其原因是_______(用离子方程式表示);
③已知在25℃:AgCl(s) ![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向KCl和K2S浓度均为0.001mol/L的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是_____(填“AgCl”或“Ag2S”)。
(2)甲醇是可再生能源,其燃烧热为726.5kJ·mol-1。下列能正确表示甲醇燃烧的热化学方程式的是____(填字母代号)。
A.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1
B.CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
O2(g)=CO2(g)+2H2O(l) △H=726.5kJ·mol-1
C.CH3OH+![]() O2=CO2+2H2O △H=726.5kJ·mol-1
O2=CO2+2H2O △H=726.5kJ·mol-1
(3)800℃,向某恒容密闭容器中充入反应物A,发生反应2A(g) ![]() 2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
2B(g)+C(g) △H<0。已知A的浓度随时间的变化如下:
反应时间((min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(A)(mol/L) | 1.0 | 0.80 | 0.67 | 0.58 | 0.43 | 0.50 | 0.50 |
请回答下列问题:
①在10-20min内,A的平均反应速率为________mol/(L.min);
②不能说明该反应达到化学平衡状态的是__________(填字母代号);
A.容器内气体密度不再变化 B.容器内气体平均摩尔质量不再变化 C.容器内气体的压强不再变化
③800℃时,平衡常数K=_________;
④若温度将为600℃,其平衡常数K将________(填“增大”、“减小”、或“不变”)。
(4)如图所示,闭合S后不久,可观察到滤纸a端附近呈蓝色,则:
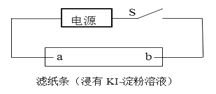
①滤纸b端与电源__________(填“正极”或“负 极”)相连;
②滤纸a端发生的电极反应式为________。