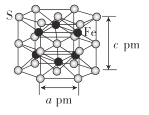
题目内容
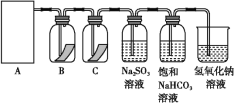
【题目】磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4,一种生产流程如下:

已知:Ca5F(PO4)3 + 7H3PO4→5Ca(H2PO4)2 + HF
38、写出有关操作的名称:Ⅰ___________、Ⅲ_________。工艺流程中设计操作Ⅱ与Ⅲ的目的是__________________________________。
39、若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由:_____________。
40、磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是____________________。
41、测定产品磷酸的浓度可采用滴定法。准确量取10.00 mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103 mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16 mL。
该实验过程中需要的定量仪器有______________________________(写名称)。
42、若理论上滴定应耗用标准溶液20.20 mL,则相对误差为______________(按近似计算法则)。该产品中磷酸的质量分数为_____________(保留3位小数)。
【答案】过滤 萃取 除去磷酸粗品中的杂质Mg2+、Fe3+等 不能使用玻璃器皿,因为HF会腐蚀玻璃。或要在密闭系统中进行,因为HF有剧毒 避免生成的石膏沉积在磷矿石表面,阻碍反应顺利进行 滴定管 1000 mL容量瓶 -0.2% 0.667
【解析】
磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质,磷矿石加入稀磷酸溶解生成磷酸二氢钙和氟化氢,加入硫酸沉淀除除氟,过滤得到彻底石膏,滤液为磷酸粗品,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,加入萃取剂萃取,分液后再加入水反萃取,用来除去磷酸粗品中的杂质Mg2+、Fe3+等,得到溶液浓缩得到较纯净的磷酸;
(1)操作Ⅰ通过过滤分离出石膏,根据图示,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,操作Ⅱ、Ⅲ是萃取和反萃取,用来除去磷酸粗品中的杂质Mg2+、Fe3+等;
(2)HF具有腐蚀性,能够腐蚀玻璃,不能使用玻璃仪器溶解磷矿石;
(3)直接用硫酸溶解磷矿石,生成的石膏会沉积在磷矿石表面;
(3)根据萃取操作用到的仪器完成;根据萃取操作中对萃取剂要求分析;
(4)定量仪器是准确量取溶液的滴定管,配制1L溶液的容量瓶;
(5)相对误差= ![]() ×100%,根据生成产物NaH2PO4和氢氧化钠的关系式及滴定数据,计算出磷酸产品的质量分数。
×100%,根据生成产物NaH2PO4和氢氧化钠的关系式及滴定数据,计算出磷酸产品的质量分数。
38.操作Ⅰ通过过滤分离出石膏,根据图示,磷酸粗品中含有H+、Ca2+、Mg2+、Fe3+离子,操作Ⅱ、Ⅲ是萃取和反萃取,萃取时,必须满足萃取剂与水互不相溶、萃取的物质在水中的溶解度较小,工艺流程中设计操作Ⅱ与Ⅲ的目的是用来除去磷酸粗品中的杂质Mg2+、Fe3+等;
故答案为:过滤;萃取;除去磷酸粗品中的杂质Mg2+、Fe3+等;
39.若在实验室里采用此种方法溶解磷矿石,由于HF具有腐蚀性,能够腐蚀玻璃,所以不能使用玻璃仪器,或要在密闭系统中进行,因为HF有剧毒;
故答案为:不能使用玻璃器皿,因为HF会腐蚀玻璃或要在密闭系统中进行,因为HF有剧毒;
40.如果直接用硫酸溶解磷矿石,生成的石膏会沉积在磷矿石表面,该工艺避免了生成的石膏沉积在磷矿石表面;
故答案为:避免生成的石膏沉积在磷矿石表面;
41.准确量取10.00mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103mol/L标准NaOH溶液滴定,该实验过程中需要的定量仪器有准确量取溶液的滴定管,配制溶液所需的1000mL的容量瓶;
故答案为:滴定管、1000mL容量瓶;
42.相对误差=![]() ×100%=
×100%=![]() ×100%=-0.2%;磷酸产品的质量是:10.00mL×1.526g/cm3=15.26g,1L磷酸产品配成的溶液消耗0.103mol/L标准NaOH溶液的体积为:20.16mL×
×100%=-0.2%;磷酸产品的质量是:10.00mL×1.526g/cm3=15.26g,1L磷酸产品配成的溶液消耗0.103mol/L标准NaOH溶液的体积为:20.16mL×![]() =1.008L,磷酸与氢氧化钠反应的关系式为:H3PO4~NaH2PO4~NaOH,n(H3PO4)=n(NaOH)=0.103mol/L×1.008L≈0.1040mol,所以该磷酸产品的质量分数为:
=1.008L,磷酸与氢氧化钠反应的关系式为:H3PO4~NaH2PO4~NaOH,n(H3PO4)=n(NaOH)=0.103mol/L×1.008L≈0.1040mol,所以该磷酸产品的质量分数为:![]() ×100%≈66.7%;
×100%≈66.7%;
故答案为:-0.2%;66.7%。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。