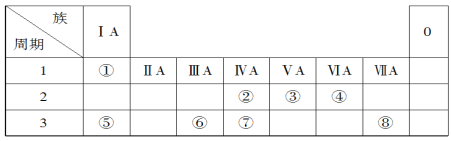
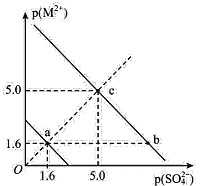
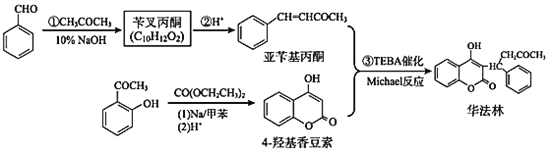
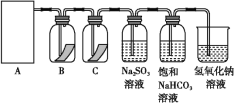
题目内容
【题目】肼(N2H4)是一种高效清洁的火箭燃料,0.5 mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ的热量,下列热化学方程式书写正确的是( )
A.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=+534 kJ/mol
B.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=-267 kJ/mol
N2(g)+H2O(g) ΔH=-267 kJ/mol
C.N2H4(g)+O2(g)= N2(g)+2H2O(g) ΔH=-534 kJ/mol
D.N2H4(g)+O2(g)= N2(g)+2H2O(l) ΔH=-534 kJ/mol
【答案】BC
【解析】
A.1mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ ×2=534kJ的热量,其焓变为负值,故A错误;
B.0.5 mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ的热量,焓变为负值,故B正确;
C.1mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ ×2=534kJ的热量,其焓变为负值,故C正确;
D.1mol气态肼完全燃烧生成氮气和水蒸气时,放出267 kJ ×2=534kJ的热量,H2O的聚集状态为气态而非液态,故D错误;
故答案为:BC。

 阅读快车系列答案
阅读快车系列答案【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有 K2Cr2O7 的废水并回收重铬酸,具体的流程如下:
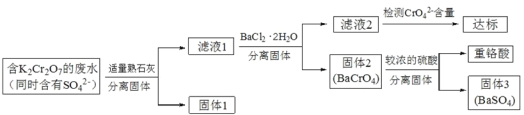
已知:CaCr2O7、BaCr2 O7 易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1106 | 2.30 102 | 1.17 1010 | 1.08 1010 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在 K2CrO4的原因(将离子方程式补充完整):______Cr2O72-+______![]() ____CrO42+______
____CrO42+______
(2)向滤液 1 中加入 BaCl2 ![]() 2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
2H2O 的目的是使 CrO42- 从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:_____。
②结合表中数据,说明选用Ba2 不选用Ca2处理废水的理由:_____。
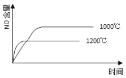
③ 研究温度对CrO42 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42- 的沉淀率(沉淀率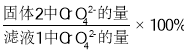 如图所示)
如图所示)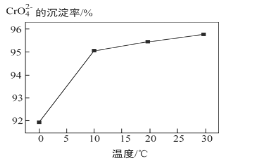
已知:![]()
CrO42- 的沉淀效率随温度变化的原因是_____。
(3)向固体2中加入硫酸,回收重铬酸。
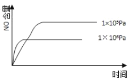
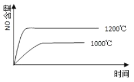
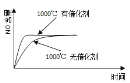
①硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用 0.450 mol/L 的硫酸时,重铬酸的回收率明显高于使用 0.225 mol/L 的硫酸的原因:_____。
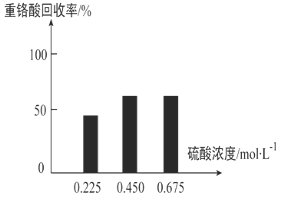
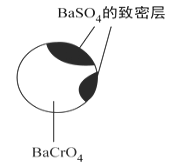
②回收重铬酸的原理如上图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_____。
(4)综上所述,沉淀BaCrO4进一步回收重铬酸的效果与_____、_____、有关。