��Ŀ����
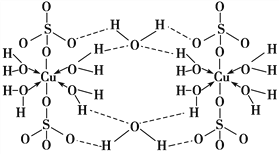
����Ŀ�����ж��ֻ�����������ơ��������ơ��������ơ�̼���ơ�̼�����Ƶȵȣ���Щ������ʵ���������й㷺��Ӧ�ã�һ������������ܽ���ת����
������м��㣺
��1����7.8��Na2O2��ȫ�ܽ���93.8��ˮ�У�������Һ�������ٷֱ�Ũ��Ϊ______��
��2����11.6�˶�����̼��ˮ�����Ļ������������Na2O2��ַ�Ӧ����������������3.6�ˣ���ԭ��������ƽ��������Ϊ______��
��3����100 mL NaOH��Һ��ͨ��CO2��ַ�Ӧ���ڼ�ѹ�ͽϵ��¶��£�С�ĵؽ���Һ���ɣ��õ���ɫ����M�������ᾧˮ����ͨ�������̼�����V(��״����)��M������W�Ĺ�ϵ����ͼ��ʾ��
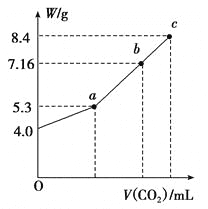
���ƶ�b��ʱM����ɳɷݣ�д��������̣�____________��
������b�������Һ��ֻ����0.03molij�ƵĻ������ַ�Ӧ��ѹ���������õ���ˮNa2CO3 8.48g�����������ʿ�����________��_______��
��4����31g NaOH��NaHCO3�Ĺ���������ܱ������м��ȵ�250��������ַ�Ӧ���ų����塢��ȴ���Ƶ�ʣ����������ΪN g���Է�����ͬNֵʱ��ʣ��������ɳɷݣ���֪NaHCO3�ķֽ��¶ȵ���250������_____________
���𰸡�8% 23.2 Na2CO3��NaHCO3�Ļ���� Na2O Na2O2 N��26.5ʱ��ʣ�����ΪNaOH��Na2CO3�Ļ���N��26.5ʱ��ʣ�����ΪNa2CO3
��������
��1��7.8��Na2O2�����ʵ���Ϊ7.8g��78g/mol=0.1mol�����ݷ�Ӧ2Na2O2+2H2O=4NaOH+O2��������������ˮ��Ӧ����0.2molNaOH���ų�0.05mol������������Һ�������ٷֱ�Ũ��Ϊ![]() ��100%=8%��
��100%=8%��
��2�����������غ㶨�ɣ��÷�Ӧ����O2������Ϊ11.6g-3.6g=8g��n(O2)=8g��32g/mol=0.25mol��CO2��H2O(g)�ֱ���Na2O2��Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2������CO2��H2O�����ʵ���֮�͡�Ϊ����Ӧ����O2���ʵ�����2��������n(CO2)��n(H2O)=0.5mol������ԭ�������ƽ��������Ϊ![]() =23.2��
=23.2��
��3������ͼ��֪����ʼʱ��������Ϊ4.0 g�����ʵ���Ϊ4.0g��40g/mol=0.1 mol������CO2��ͨ�����η�����ӦCO2+2NaOH=Na2CO3+H2O��CO2+Na2CO3+H2O=2NaHCO3����ȫ������̼���ƣ�����������Ϊ0.05mol��106g/mol=5.3 g����ȫ������̼�����ƣ�����������Ϊ0.1mol��84g/mol=8.4 g��b���Ӧ�Ĺ���M������Ϊ7.16 g������5.3 g��8.4 g֮�䣬��b���Ӧ�Ĺ���Ϊ̼���ƺ�̼�����ƵĻ���
����b���Ӧ�Ĺ�����̼���ơ�̼�����Ƶ����ʵ����ֱ�Ϊx��y������106 g��mol��1��x��84 g��mol��1��y=7.16 g��2x��y=0.1 mol�����x=0.02 mol��y=0.06 mol��8.48 g Na2CO3�����ʵ���Ϊ8.48g��106g/mol=0.08 mol�������⣬0.06 mol NaHCO3��0.06 mol Na2CO3�������ķ�ӦΪNaHCO3��NaOH=Na2CO3��H2O��n(NaOH)=0.06 mol��0.03molij�ƵĻ���������ˮ����0.06 mol�������Ƶ������й������ơ������ơ�
��4������ʱ���������һ�������ķ�Ӧ��
NaOH+NaHCO3![]() Na2CO3+H2O
Na2CO3+H2O
40 84 18
�ɼ���40gNaOH��84gNaHCO3ǡ����ȫ��Ӧ��������������18g������31g������еĹ���ǡ����ȫ��Ӧ��������ٵ�����Ϊ![]() ��31g=4.5g��ʣ���������Ϊ31g-4.5g=26.5g��
��31g=4.5g��ʣ���������Ϊ31g-4.5g=26.5g��
��ʣ����������Ng=26.5g��ʣ�����ijɷ�Ϊ̼���ƣ�
����Ӧ����������ʣ�࣬���ٵ�����С��4.5g����Ng>26.5g��ʣ�����ĵ����Ϊ̼���ƺ��������ƣ�
����Ӧ��̼������ʣ�࣬ʣ��̼�����Ʒֽ��̼���ơ�ˮ�Ͷ�����̼������ٵ���������4.5g����Ng<26.5g��ʣ�����ĵ����Ϊ̼���ƣ�
����������N��26.5ʱ��ʣ�����ΪNaOH��Na2CO3�Ļ�ϣ�N��26.5ʱ��ʣ�����ΪNa2CO3��

 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�����Ŀ������K2Cr2O7�ķ�ˮ���н�ǿ�Ķ��ԣ���ҵ�ϳ��ñ��γ������������� K2Cr2O7 �ķ�ˮ�������ظ��ᣬ������������£�
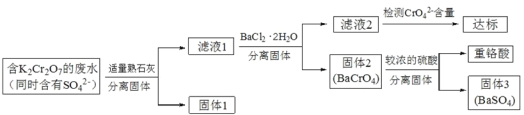
��֪��CaCr2O7��BaCr2 O7 ������ˮ�������������ڳ����µ��ܶȻ����±���ʾ��
���� | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
�ܶȻ� | 9.1106 | 2.30 102 | 1.17 1010 | 1.08 1010 |
(1)�����ӷ���ʽ��ʾK2Cr2O7��Һ��ͬʱ���� K2CrO4��ԭ��(�����ӷ���ʽ��������)��______Cr2O72-+______![]() ____CrO42+______
____CrO42+______
(2)����Һ 1 �м��� BaCl2 ![]() 2H2O ��Ŀ����ʹ CrO42- ����Һ�г���������
2H2O ��Ŀ����ʹ CrO42- ����Һ�г���������
�ٽ����������˵����ʯ�ҵ����ã�_____��
�ڽ�ϱ������ݣ�˵��ѡ��Ba2 ��ѡ��Ca2������ˮ�����ɣ�_____��
�� �о��¶ȶ�CrO42 ����Ч�ʵ�Ӱ�졣ʵ�������£�����ͬ��ʱ�����ڣ���ͬ�¶���CrO42- �ij�����(������ ��ͼ��ʾ)
��ͼ��ʾ)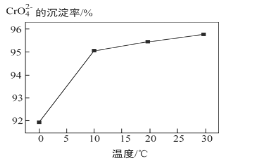
��֪��![]()
CrO42- �ij���Ч�����¶ȱ仯��ԭ����_____��
(3)�����2�м������ᣬ�����ظ��ᡣ
������Ũ�ȶ��ظ���Ļ���������ͼ(��)��ʾ����ϻ�ѧƽ���ƶ�ԭ��������ʹ�� 0.450 mol/L ������ʱ���ظ���Ļ��������Ը���ʹ�� 0.225 mol/L �������ԭ��_____��
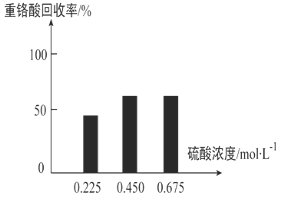
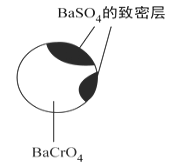
�ڻ����ظ����ԭ������ͼ(��)��ʾ��������Ũ�ȸ���0.450 mol/Lʱ���ظ���Ļ�����û�����Ա仯����ԭ����_____��
(4)��������������BaCrO4��һ�������ظ����Ч����_____��_____���йء�
����Ŀ�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2���䷴ӦΪ��2NO+2CO![]() 2CO2+N2�����º�÷�Ӧ��ƽ�ⳣ�����Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2+N2�����º�÷�Ӧ��ƽ�ⳣ�����Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c��NO����mol/L�� | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
c��CO����mol/L�� | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
��ش��������⣨���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
��1����Ӧ��Q___0����д������������������=������
��2��ǰ2s�ڵ�ƽ����Ӧ����v��N2��=___��
��3�������ڸ��¶��£���Ӧ��ƽ�ⳣ��K=___��
��4���������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���___��
A��ѡ�ø���Ч�Ĵ���
B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶�
D�������������
��5���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С�
ʵ�� ��� | T���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�� ��mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
�� | ___ | ___ | ___ | 124 |
�� | 350 | ___ | ___ | 124 |
�������ϱ��ո�������ʣ���ʵ���������ݡ�
�����ڸ���������ͼ�У������ϱ��е�����ʵ�������»��������NOŨ����ʱ��仯����������ͼ���������������ߵ�ʵ����___��