题目内容
下列有关物质性质的比较正确的是( )
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3.
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3.
| A、①③ | B、②④ | C、③⑥ | D、⑤⑥ |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:①同主族元素的单质从上到下,非金属性减弱,碱金属元素单质熔点降低、卤族元素单质熔点升高;
②主族元素的最高正化合价在数值上等于它所在的族序数,但O、F元素除外;
③同周期主族元素的原子半径越小,越难失去电子,得电子能力逐渐增强;
④元素的非金属性越强,它的气态氢化物水溶液的酸性越弱;
⑤元素的非金属性越弱,其简单阴离子的还原性越强;
⑥元素的非金属性越强,其最高价氧化物的水化物酸性越强.
②主族元素的最高正化合价在数值上等于它所在的族序数,但O、F元素除外;
③同周期主族元素的原子半径越小,越难失去电子,得电子能力逐渐增强;
④元素的非金属性越强,它的气态氢化物水溶液的酸性越弱;
⑤元素的非金属性越弱,其简单阴离子的还原性越强;
⑥元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:①同主族元素的单质从上到下,非金属性减弱,金属性增强,碱金属元素单质熔点降低,卤族元素单质熔点升高,故错误;
②主族元素的最高正化合价在数值上等于它所在的族序数,但O、F元素除外,副族元素其最高正化合价与其族序数不一定相等,故错误;
③同周期主族元素的原子半径越小,越难失去电子,得电子能力越强强,非金属性越强,故正确;
④元素的非金属性越强,其阴离子结合氢离子能力越强,则其气态氢化物水溶液酸性越弱,故错误;
⑤元素的非金属性越弱,其简单阴离子的还原性越强,非金属性Se>S>Br>Cl,其简单阴离子还原性Se2->S2->Br->Cl-,故错误;
⑥元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故正确;
故选C.
②主族元素的最高正化合价在数值上等于它所在的族序数,但O、F元素除外,副族元素其最高正化合价与其族序数不一定相等,故错误;
③同周期主族元素的原子半径越小,越难失去电子,得电子能力越强强,非金属性越强,故正确;
④元素的非金属性越强,其阴离子结合氢离子能力越强,则其气态氢化物水溶液酸性越弱,故错误;
⑤元素的非金属性越弱,其简单阴离子的还原性越强,非金属性Se>S>Br>Cl,其简单阴离子还原性Se2->S2->Br->Cl-,故错误;
⑥元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故正确;
故选C.
点评:本题考查了元素周期律的综合应用,明确元素非金属性与其简单阴离子的还原性、最高价氧化物的水化物酸性之间的关系及元素周期律即可解答,注意元素的非金属性越强,其氢化物的水溶液酸性不一定强,HF属于弱酸,为易错点.

练习册系列答案
相关题目
化学与人们的生活、健康密切相关.下列做法不合理的是( )
| A、用灼烧和闻气味的方法区别棉织物和纯毛织物 |
| B、用透析的手段净化尿毒症患者的血液 |
| C、用米汤检验加碘食盐中的KI03 |
| D、向豆浆中加入盐卤制做豆腐 |
下列离子方程式书写正确的是( )
| A、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| B、利用腐蚀法制作印刷线路析:Fe3++Cu═Fe2++Cu2+ | ||||
C、用铜电极电解硫酸铜溶液:2Cu2++2H2O
| ||||
| D、硫酸氧钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
下列离子方程式正确的是( )
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ |
| C、向FeI2中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO2↑+H2O |
下面关于氢化物的叙述正确的是( )
| A、一个D2O分子所含的中子数为8 |
B、NH3的结构式为: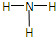 |
C、HCl的电子式为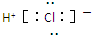 |
| D、热稳定性:HCl>HF |
对于可逆反应H2(g)+I2(g)?2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、若平衡正向移动,则V正一定增大 |
| C、正、逆反应速率的比值是恒定的 |
| D、达到平衡时,正、逆反应速率相等 |
下列对于“摩尔”的理解正确的是( )
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、32g O2中所含氧原子数为NA个 |
| C、1mol氧约含6.02×1023个O2 |
| D、摩尔是物质的量的单位,简称摩,符号为mol |
 2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.