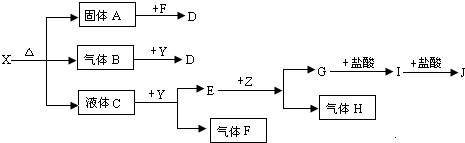
题目内容
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物.
(1)写出基态Fe3+的核外电子排布式 .
(2)CN-中碳原子的杂化方式为 .
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 .
(4)写出一种与SCN-互为等电子体的分子 .(用化学式表示)
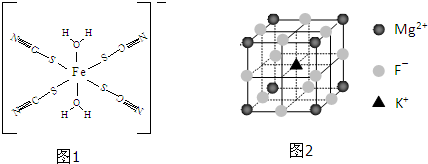
(5)图1是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示).
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如图2).该晶体的化学式为 .
(1)写出基态Fe3+的核外电子排布式
(2)CN-中碳原子的杂化方式为
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为
(4)写出一种与SCN-互为等电子体的分子
(5)图1是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示).
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如图2).该晶体的化学式为

考点:原子核外电子排布,配合物的成键情况,“等电子原理”的应用,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)Fe元素原子失去4s能级2个电子及3d能级1个电子形成Fe3+;
(2)CN-为直线型,碳原子的杂化方式为sp;
(3)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N;
(4)原子总数、价电子总数相同的微粒互为等电子体;
(5)S、O都有孤电子对,可以提供孤对电子,与铁离子形成配位键;
(6)根据均摊法计算晶胞中F-、Mg2+、K+离子数目确定化学式.
(2)CN-为直线型,碳原子的杂化方式为sp;
(3)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N;
(4)原子总数、价电子总数相同的微粒互为等电子体;
(5)S、O都有孤电子对,可以提供孤对电子,与铁离子形成配位键;
(6)根据均摊法计算晶胞中F-、Mg2+、K+离子数目确定化学式.
解答:
解:(1)Fe原子核外电子排布为:1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子及3d能级1个电子形成Fe3+,Fe3+的核外电子排布为:1s22s22p63s23p63d5,故答案为:1s22s22p63s23p63d5;
(2)CN-为直线型,碳原子的杂化方式为sp,故答案为:sp;
(3)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,(CN)2中π键和σ键的个数比为4:3,故答案为:4:3;
(4)原子总数、价电子总数相同的微粒互为等电子体,与SCN-互为等电子体的分子为CS2或CO2,故答案为:CS2或CO2;
(5)S、O都有孤电子对,可以提供孤对电子,与铁离子形成配位键,该配合物中的配位键为: ,故答案为:
,故答案为: ;
;
(6)晶胞中F-离子数目=12×
=3、Mg2+离子数目=8×
=1、K+离子数目=1,故该晶体化学式为:KMgF3,故答案为:KMgF3.
(2)CN-为直线型,碳原子的杂化方式为sp,故答案为:sp;
(3)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,(CN)2中π键和σ键的个数比为4:3,故答案为:4:3;
(4)原子总数、价电子总数相同的微粒互为等电子体,与SCN-互为等电子体的分子为CS2或CO2,故答案为:CS2或CO2;
(5)S、O都有孤电子对,可以提供孤对电子,与铁离子形成配位键,该配合物中的配位键为:
 ,故答案为:
,故答案为: ;
;(6)晶胞中F-离子数目=12×
| 1 |
| 4 |
| 1 |
| 8 |
点评:本题考查核外电子排布、杂化轨道、化学键、等电子体、晶胞计算等,难度不大,注意配位键的形成条件,利用均摊法进行晶胞有关计算.

练习册系列答案
相关题目
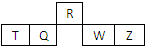 短周期元素R、T、Q、W、Z在元素周期表中的相对位置如下图所示,五种元素中只有一种金属元素.下列判断错误的是( )
短周期元素R、T、Q、W、Z在元素周期表中的相对位置如下图所示,五种元素中只有一种金属元素.下列判断错误的是( )| A、W的单质易溶于CS2 |
| B、Q与R可能形成化合物Q3R4 |
| C、T的最高价氧化物的对应水化物为强碱 |
| D、W、Z都有多种含氧酸 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、7.8g Na2O2所含的阴离子数目为2NA |
| B、在熔融状态下,lmol KHSO4完全电离出的阳离子数目为2NA |
| C、14g乙烯和丙烯的混和气体中共含有3NA对共用电子对 |
| D、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |