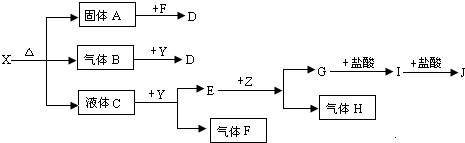
题目内容
 2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.
2003年10月16日“神舟五号”飞船成功发射,实现了中华民族的飞天梦想.运送飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物.已知该化合物中氢元素的质量分数为12.5%,相对分子质量为32,结构分析发现该分子结构中只有单键.(1)该氮氢化合物的电子式为
(2)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于NH4+的性质.
①N2H4能与硫酸反应生成N2H6SO4(类似于氨气和硫酸反应本质).则N2H6SO4的晶体内不存在
②写出N2H62+在碱性溶液中反应的离子方程式
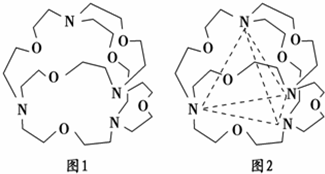
(3)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别.
下列分子或离子中,能被该有机化合物识别的是
a.CF4 b.CH4 c.NH4+ d.H2O.
考点:化学键,电子式
专题:化学键与晶体结构
分析:(1)该氮氢化合物中N(H)=
=4,故分子中N(N)=
=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对;
(2)①N2H6SO4为离子晶体,含有离子键、共价键和配位键;
②N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中质子与氢氧根结合生成水;
(3)本题中嵌入某微粒分别与4个N原子形成4个氢键.
| 32×12.5% |
| 1 |
| 32-4 |
| 14 |
(2)①N2H6SO4为离子晶体,含有离子键、共价键和配位键;
②N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中质子与氢氧根结合生成水;
(3)本题中嵌入某微粒分别与4个N原子形成4个氢键.
解答:
解:(1)该氮氢化合物中N(H)=
=4,故分子中N(N)=
=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为 ,
,
故答案为: ;
;
(2)①N2H6SO4为离子晶体,含有离子键、共价键和配位键,不存在范德华力,故答案为:d;
②N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
故答案为:N2H62++2OH-=N2H4+2H2O;
(3)注意氢键的形成条件及成键元素(N、O、F、H),本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+,故答案为:c.
| 32×12.5% |
| 1 |
| 32-4 |
| 14 |
 ,
,故答案为:
 ;
;(2)①N2H6SO4为离子晶体,含有离子键、共价键和配位键,不存在范德华力,故答案为:d;
②N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
故答案为:N2H62++2OH-=N2H4+2H2O;
(3)注意氢键的形成条件及成键元素(N、O、F、H),本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+,故答案为:c.
点评:本题考查考查原子结构与性质,涉及化学键的类型和判断等知识,综合考查学生的分析能力和基本概念的综合运用能力,为高考常见题型和高频考点,注意相关基础知识的学习,难度中等.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、向漂白液中通入过量CO2:ClO-+H2O+CO2═HClO+HCO3- |
| B、将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O |
| C、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
| D、将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |