题目内容
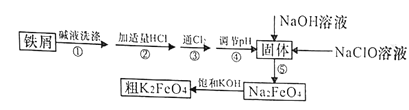
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。
【答案】+6 CO32-+ H2O![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O![]() H2CO3 + OH-(写出第1 步即可) 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 111.75 2. 94~7.60 淀粉 当最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色且半分钟内不复原 90.0%
H2CO3 + OH-(写出第1 步即可) 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 111.75 2. 94~7.60 淀粉 当最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色且半分钟内不复原 90.0%
【解析】
由题给流程可知,用碳酸钠溶液除去铁屑表面的油污后,加入适量盐酸溶解废铁屑,铁与盐酸反应生成氯化亚铁和氢气,再通入氯气,氯气将氯化亚铁氧化为氯化铁,调节溶液pH,使氯化铁转化为氢氧化铁沉淀,过滤;向过滤所得氢氧化铁中加入氢氧化钠溶液和次氯酸钠溶液,在碱性条件下,氢氧化铁被次氯酸钠氧化为高铁酸钠,向高铁酸钠溶液中加入饱和氢氧化钾溶液,过滤得粗高铁酸钾。
(1)由化合价代数和为零可知,高铁酸钾中铁元素为+6价,故答案为:+6;
(2)碳酸钠在溶液中水解使溶液呈碱性,可以除去铁屑表面的油污,水解的离子方程式为CO32-+ H2O ![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O ![]() H2CO3 + OH-,故答案为:CO32-+ H2O
H2CO3 + OH-,故答案为:CO32-+ H2O ![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O ![]() H2CO3 + OH-;
H2CO3 + OH-;
(3)步骤③发生的反应为氯气将氯化亚铁氧化为氯化铁,反应的离子方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,故答案为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-;
(4)步骤⑤的反应是在碱性条件下,氢氧化铁被次氯酸钠氧化为高铁酸钠,由得失电子数目守恒可得n(NaClO)×2=n(Na2FeO4)×3,解得n(NaClO)=1.5mol,则NaClO的质量为1.5mol×74.5g/mol=111.75g;步骤④调节pH的目的是使氯化铁转化为氢氧化铁沉淀,而Ni2+不转化为沉淀,由题给数据可知,pH的范围是2. 94~7.60,故答案为:111.75;2. 94~7.60;
(5)①由题给方程式可知,滴定时是用Na2S2O3标准溶液滴定生成的I2,则应选用淀粉溶液做指示剂,滴定前溶液呈蓝色,当单质碘完全反应时,溶液蓝色褪去,且半分钟内不复原,故答案为:淀粉;当最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色且半分钟内不复原;
②由题给方程式可得如下关系:K2FeO4—2I2—4Na2S2O3,则n(Na2FeO4)=![]() =
=![]() =0.001mol,则粗K2FeO4的纯度为
=0.001mol,则粗K2FeO4的纯度为![]() ×100%=90.0%,故答案为:90.0%。
×100%=90.0%,故答案为:90.0%。