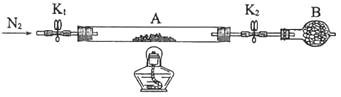
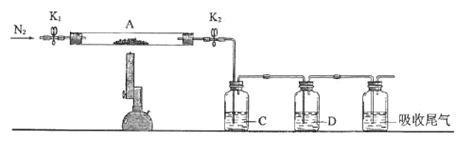
题目内容
【题目】Ⅰ.过渡金属元素性质研究在无机化学中所占的比重越来越大。
(1)铜元素在周期表的位置是______。
(2)比较NH3和[Cu(NH3)2]2+中H-N-H键角的大小:NH3______[Cu(NH3)2]2+(填“>”或“<”),并说明理由______。
(3)铜金合金是一种储氢材料,晶胞参数anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞的顶点位置。已知阿伏加德罗常数的数值为NA,铜、金的摩尔质量分别为M(Cu)、M(Au),该晶体的密度为______g/cm3;氢原子可以进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为______。
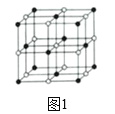
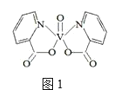
(4)研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1,在图中画出由钒离子形成的配合物中的配位键______。
Ⅱ.氮元素可以形成多种化合物。
(5)NO3-的立体构型的名称是______,NO3-的一种等电子体为______。
(6)硫酸和硝酸都是常见的强酸,但性质差异明显:硫酸是粘稠的油状液体,沸点338℃;硝酸是无色液体,沸点仅为122℃,试从氢键的角度解释原因:______。
(7)图2表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的四个顶点(见图3),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是______(填标号)。
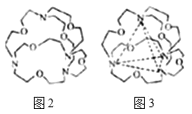
a.CF4 b.CH4 c.NH4+ d.H2O
【答案】第四周期第ⅠB族 < 因为NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大 ![]() H8Cu3Au
H8Cu3Au 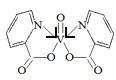 平面正三角形 CO32- 硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低 c
平面正三角形 CO32- 硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低 c
【解析】
Ⅰ.(1)铜元素在周期表的位置是第四周期第ⅠB族。故答案为:第四周期第ⅠB族;
(2)氨分子中有孤电子对,孤电子对对成键电子对作用力大,NH3和[Cu(NH3)2]2+中H-N-H键角的大小:NH3<[Cu(NH3)2]2+,理由:因为NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大。
故答案为:< ;因为NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大;
(3)铜金合金是一种储氢材料,晶胞参数anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞的顶点位置。该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,
=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=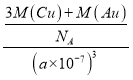 g·cm-3=
g·cm-3=![]() g·cm-3;
g·cm-3;
晶胞中Cu原子处于面心,Au原子处于顶点位置,Au原子为3个面的顶点,晶胞中Au原子与面心Cu原子构成8个四面体空隙,氢原子进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为H8Cu3Au。
故答案为:![]() ;H8Cu3Au;
;H8Cu3Au;
(4)根据如图1,N原子最外层5个电子,其中2个电子与碳形成碳碳双键,1个电子与碳形成单键,孤电子对进入V的空轨道,形成配位键,在图中画出由钒离子形成的配合物中的配位键,如图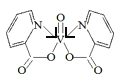 。
。
故答案为: ;
;
Ⅱ.(5)NO3-的中心原子价层电子对=3+![]() =3,sp2杂化,立体构型的名称是平面正三角形,NO3-的一种等电子体为CO32-、SO3等。
=3,sp2杂化,立体构型的名称是平面正三角形,NO3-的一种等电子体为CO32-、SO3等。
故答案为:平面正三角形 ;CO32- ;
(6)硫酸和硝酸都是常见的强酸,但性质差异明显,从氢键的角度解释原因:硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低。
故答案为:硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低;
(7)由氢键的形成条件及成键元素(N、O、F、H)可知,本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+。
故答案为:c。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
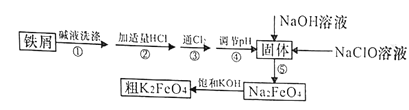
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。