题目内容
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )
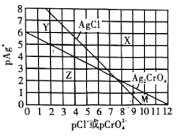
A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
【答案】D
【解析】
A.依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq);Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1210-12=10-12,AgCl的沉淀溶解平衡为:AgCl (s)
2Ag+(aq)+CrO42-(aq);Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=1210-12=10-12,AgCl的沉淀溶解平衡为:AgCl (s)![]() Ag+(aq)+Cl-(aq);Ksp(AgCl)=c(Ag+)·c(Cl-)=10-310-7=10-10,A正确;
Ag+(aq)+Cl-(aq);Ksp(AgCl)=c(Ag+)·c(Cl-)=10-310-7=10-10,A正确;
B.在难溶化合物的溶解平衡曲线下方的点,溶液中离子浓度幂之积大于其Ksp,可以形成该物质的沉淀,在溶解平衡曲线上方的点溶液中离子浓度幂之积小于其Ksp,不可以形成该物质的沉淀,M区域在AgCl溶解曲线上方而处于Ag2CrO4沉淀下方,所以M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀,B正确;
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,形成AgCl沉淀需要Ag+的浓度c(Ag+)=![]() =10-9mol/L;形成Ag2CrO4沉淀需要Ag+的浓度c(Ag+)=
=10-9mol/L;形成Ag2CrO4沉淀需要Ag+的浓度c(Ag+)=![]() =3.162×10-6mol/L>10-9mol/L,形成AgCl沉淀需要的Ag+小,因此会先析出AgCl沉淀,C正确;
=3.162×10-6mol/L>10-9mol/L,形成AgCl沉淀需要的Ag+小,因此会先析出AgCl沉淀,C正确;
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水,其中仍然存在Ag2CrO4、AgCl的沉淀溶解平衡,温度不变,所以 不变,D错误;
不变,D错误;
故合理选项是D。

 阅读快车系列答案
阅读快车系列答案【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
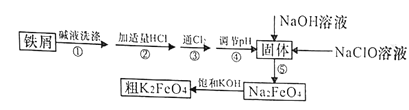
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。