题目内容
11. 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
分析 有机物分子中含酚-OH、碳碳双键、-COOH、氨基及-CONH-,结合苯酚、烯烃、氨基酸、肽键性质来解答.
解答 解:A.含有氨基,可与HCl反应,故A错误;
B.手性碳原子如图所示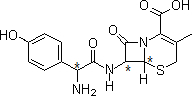 ,共3个,故B错误;
,共3个,故B错误;
C.苯环、碳碳双键均可与氢气发生加成反应,则在催化剂存在的条件下,1mol头孢羟氨苄消耗4molH2,故C错误;
D.分子中含有酚羟基,在空气中可被氧化,不能稳定存在,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重烯烃、苯酚、羧酸、肽键性质的考查,题目难度不大.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
2.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| D. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |
6.下列关于电离常数的说法正确的是( )
| A. | 电离常数随着弱电解质浓度的增大而增大 | |
| B. | CH3COOH的电离常数表达式为Ka=$\frac{c(C{H}_{3}COOH)}{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}$ | |
| C. | 电离常数只受温度影响,与浓度无关 | |
| D. | CH3COOH溶液中加入少量CH3COONa固体,电离常数减小 |
16.如图是元素周期表的一部分:
请用表中序号①~⑨的元素符号或化学式填空:
(1)在这些元素中,化学性质最不活泼的元素符号为Ar,其原子的原子结构示意图为 .
.
(2)地壳中含量最多的金属元素是Al;⑦、⑧两种元素的氢化物稳定性由强到弱的顺序为HCl>H2S.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH.
(5)元素③的氢氧化物溶液与元素⑤的氢氧化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,化学性质最不活泼的元素符号为Ar,其原子的原子结构示意图为
 .
.(2)地壳中含量最多的金属元素是Al;⑦、⑧两种元素的氢化物稳定性由强到弱的顺序为HCl>H2S.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH.
(5)元素③的氢氧化物溶液与元素⑤的氢氧化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O.
20.如表是元素周期表的一部分,针对表中的①⑩种元素,用 元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 .
.
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
1. 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 向该体系中加入饱和NaOH溶液,溶解平衡向右移动 | |
| B. | 向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 | |
| C. | 该平衡的Ksp=c(Ca2+)•c(K+)•c(Mg2+)•c(SO42-) | |
| D. | 升高温度,反应速率增大,平衡向正反应方向移动 |
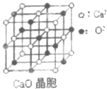 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,

 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
.