题目内容
16.如图是元素周期表的一部分:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,化学性质最不活泼的元素符号为Ar,其原子的原子结构示意图为
 .
.(2)地壳中含量最多的金属元素是Al;⑦、⑧两种元素的氢化物稳定性由强到弱的顺序为HCl>H2S.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH.
(5)元素③的氢氧化物溶液与元素⑤的氢氧化物反应的离子方程式为:OH-+Al(OH)3=AlO2-+2H2O.
分析 由元素在周期表中位置,可知①为C、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar,
(1)最不活泼的元素为惰性气体元素,为Ar;
(2)地壳中含量最多的金属元素是Al元素,元素的非金属性越强,对应的氢化物越稳定;
(3)元素非金属性越强,最高价氧化物对应水化物酸性越强,元素的金属性越强,对应的最高价氧化物的碱性越强,碱性最强的为NaOH,
(4)③Na的最高价氧化物的水化物是NaOH,⑤Al的最高价氧化物的水化物是Al(OH)3,二者反应生成偏铝酸钠.
解答 解:由元素在周期表中位置,可知①为C、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar,
(1)最不活泼的元素为惰性气体元素,为Ar,原子结构示意图为 ,故答案为:Ar;
,故答案为:Ar; ;
;
(2)地壳中含量最多的金属元素是Al元素,非金属性Cl>S,则稳定性HCl>H2S,故答案为:Al;HCl>H2S;
(3)元素非金属性越强,最高价氧化物对应水化物酸性越强,由于F正化合价、O无最高正价,因此最高价氧化物对应水化物酸性最强的是HClO4,元素的金属性越强,对应的最高价氧化物的碱性越强,碱性最强的为NaOH,
故答案为:HClO4;NaOH;
(4)③Na的最高价氧化物的水化物是NaOH,⑤Al的最高价氧化物的水化物是Al(OH)3,反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O,
故答案为:OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查元素周期表的结构和元素周期律,通过短周期元素和所给元素周期表的结构推出是何种元素是解题的关键,试题比较基础,难度中等.

练习册系列答案
相关题目
6.在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是( )
| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂为I2 | |
| C. | 该反应中还原剂为KClO3 | |
| D. | 该反应中KClO3被还原为Cl2,I2被氧化为KIO3 |
7. 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
 如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )
如图为常温下用0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸和20.00mL 0,.1000 mol•L-1醋酸的曲线.若以HA表示酸,下列判断和说法不正确的是( )| A. | 如图是滴定盐酸的曲线 | |
| B. | 当0 mL<V(NaOH)<20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-)>c(Na+)>c(H+)>c(OH-) | |
| C. | B点时,反应消耗溶液体积:V(NaOH)<V(HA) | |
| D. | E点时溶液中离子浓度为c(Na+)=c(A-) |
4.对一已经达到化学平衡的体系,下列说法正确的是( )
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 化学平衡发生移动时,化学反应速率一定变化 | |
| C. | 正反应进行的程度越大,正反应速率一定越大 | |
| D. | 使化学反应速率发生变化,而化学平衡不移动的影响因素,一定是催化剂 |
11. 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
8.同温同压下,两种气体的体积如果不相同,其主要原因是( )
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
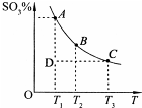 硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: