题目内容
3.如图,化合物F是用于制备药品盐酸祛炎痛的中间产物,其合成路线为:
已知:
(Ⅰ)RNH2+R′CH2Cl$\stackrel{一定条件}{→}$RNHCH2R′+HCl(R和R′代表烃基)
(Ⅱ)苯的同系物能被酸性高锰酸钾溶液氧化,如:

(Ⅲ)
 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)(Ⅳ) A与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
请回答下列问题:
(1)C的结构简式是
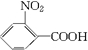 .
.(2)D+E→F的化学方程式:
 .
.(3)能够鉴定D中氯元素存在的操作是C(填选项).
A.在D中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
(4)反应①~⑤中,属于取代反应的是(填反应序号)①②⑤.
分析 甲苯在光照条件发生甲基上取代反应生成 ,由A系列反应得到E,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知B为
,由A系列反应得到E,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知B为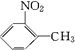 ,C为
,C为 ,D和E发生取代反应,由信息Ⅰ可知生成F为
,D和E发生取代反应,由信息Ⅰ可知生成F为 ,据此解答.
,据此解答.
解答 解:甲苯在光照条件发生甲基上取代反应生成 ,由A系列反应得到E,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知B为
,由A系列反应得到E,反应中引入-COOH、-NH2,且处于邻位,甲基氧化得到-COOH,由题目信息可知,-NO2还原得到-NH2,由于苯胺易被氧化,所以用KMnO4(H+)先氧化-CH3成-COOH,再将-NO2还原得到-NH2,故A转化得到B是甲苯的硝化反应,可知B为 ,C为
,C为 ,D和E发生取代反应,由信息Ⅰ可知生成F为
,D和E发生取代反应,由信息Ⅰ可知生成F为 ,
,
(1)由上述分析可知,C的结构简式是 ,故答案为:
,故答案为: ;
;
(2)结合已知反应Ⅰ,D+E→F的反应方程式为: ,
,
故答案为: ;
;
(3)D不存在氯离子,不能利用硝酸银溶液直接检验,不能发生消去反应,可以加入NaOH溶液,加热,发生取代反应得到苯甲醇与NaCl,再加入稀硝酸酸化,然后加入AgNO3溶液,由白色沉淀生成,是什么含有氯元素,故答案为:C;
(4)反应①属于取代反应,反应②属于取代反应,反应③属于氧化反应,反应④属于还原反应,反应⑤属于取代反应,故答案为:①②⑤.
点评 本题考查有机物的推断与合成,根据题目信息结合有机物的结构判断发生的反应,进而推断其它物质的结构简式,注意掌握有机物官能团的性质与转化,难度中等.

练习册系列答案
相关题目
13. 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
(1)Y在周期表中的位置是第二周期ⅥA族.
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应式是N2H4-4e-+4OH-═N2+4H2O.
(5)工业上用如图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂丙.该反应的离子方程式是Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.丙的电子式 .
.
(6)洁厕灵的主要成分是HCl.下列关于卤化氢的性质比较中错误的是AC
A.酸性:HF>HCl>HBr>HI B.键能:H-F>H-Cl>H-Br>H-I
C.沸点:HF<HCl<HBr<HI D.还原性:HF<HCl<HBr<HI.
 6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应式是N2H4-4e-+4OH-═N2+4H2O.
(5)工业上用如图所示装置电解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂丙.该反应的离子方程式是Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑.丙的电子式
 .
.(6)洁厕灵的主要成分是HCl.下列关于卤化氢的性质比较中错误的是AC
A.酸性:HF>HCl>HBr>HI B.键能:H-F>H-Cl>H-Br>H-I
C.沸点:HF<HCl<HBr<HI D.还原性:HF<HCl<HBr<HI.
14.如图所示,试管中盛有已检出部分离子的某溶液,下列推理正确的是( )


| A. | 向该溶液中加入Mg有H2逸出 | |
| B. | 向该溶液中加入少量FeCl2,其离子反应方程式为:2NO3-+6I-+4H2O | |
| C. | 该溶液还可能大量存在MnO4-、ClO- | |
| D. | 向该溶液中逐滴加入Na2CO3溶液至过量,既有气体逸出又有沉淀生成 |
11. 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
8.同温同压下,两种气体的体积如果不相同,其主要原因是( )
| A. | 气体的分子大小不同 | B. | 气体分子间的平均距离不同 | ||
| C. | 气体的性质不同 | D. | 气体的物质的量不同 |
12.下列各组有机物,不管它们以何种比例混合,只要物质的量一定,则完全燃烧时消耗氧气为一定值的是( )
| A. | C4H6 C3H8 | B. | C5H10 C6H6 | C. | C2H6O C2H4O2 | D. | C3H6 C3H8O |
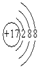

 ,化合物中含有离子键键(填离子或共价)
,化合物中含有离子键键(填离子或共价)
 .
. .
.