题目内容
1. 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 向该体系中加入饱和NaOH溶液,溶解平衡向右移动 | |
| B. | 向该体系中加入饱和碳酸钠溶液,溶解平衡向右移动 | |
| C. | 该平衡的Ksp=c(Ca2+)•c(K+)•c(Mg2+)•c(SO42-) | |
| D. | 升高温度,反应速率增大,平衡向正反应方向移动 |
分析 反应K2SO4•MgSO4•2CaSO4(s)═2Ca2++2K++Mg2++4SO42-,Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-),加入NaOH或饱和碳酸钠溶液,可分别与Mg2+、Ca2+反应,平衡正向移动,升高温度,平衡常数增大,说明平衡正向移动,以此解答该题.
解答 解:A.已知K2SO4•MgSO4•2CaSO4(s)?2Ca2++2K++Mg2++4SO42-,加入饱和NaOH溶液,氢氧根离子和镁离子结合生成氢氧化镁沉淀,c(Mg2+)减小,溶解平衡右移,故A正确;
B.加入饱和碳酸钠,CO32-和Ca2+结合生成碳酸钙沉淀,c(Ca2+)减小,溶解平衡右移,故B正确;
C.已知K2SO4•MgSO4•2CaSO4(s)?2Ca2++2K++Mg2++4SO42-,则该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-),故C错误;
D.由图可知,升高温度,达到平衡需要的时间缩短,即反应速率增大;升高温度,c(K+)增大,即平衡正移,故D正确.
故选C.
点评 本题考查了沉淀溶解平衡的影响因素分析判断,图象分析判断方法,溶度积的表达式等,注意对图象的分析理解是解题的关键,题目难度中等.

练习册系列答案
相关题目
11. 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
 头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应较小,因而被广泛适用于敏感细菌所致的多种疾病治疗.下列对头孢羟氨苄的说法中正确的是( )| A. | 头孢羟氨苄可与NaOH溶液反应但不与HCl反应 | |
| B. | 该化合物中含有4个手性碳原子 | |
| C. | 在催化剂存在条件下,1mol头孢羟氨苄可与7molH2发生反应 | |
| D. | 头孢羟氨苄不能在空气中稳定存在 |
12.下列各组有机物,不管它们以何种比例混合,只要物质的量一定,则完全燃烧时消耗氧气为一定值的是( )
| A. | C4H6 C3H8 | B. | C5H10 C6H6 | C. | C2H6O C2H4O2 | D. | C3H6 C3H8O |
9.2L密闭容器中,反应2SO2(g)+O2(g)═2SO3(g),经一段时间后SO3的浓度增加了0.8mol,在这段时间内用O2表示的反应速率为0.4mol•L-1•min-1,则这段时间为( )
| A. | 0.5s | B. | 1s | C. | 30s | D. | 60s |
6.从某些性质来看,NH3和H2O;NH4+和H3O+;NH2-和OH-;N3-和O2-两两类似,据此判断下列反应:
(1)2Na+2NH3=2NaNH2+H2↑
(2)CaO+2NH4Cl=CaCl2+2NH3↑+H2O
(3)3Mg(NH2)2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2+4NH3↑
(4)NH4Cl+NaNH2=NaCl+2NH3↑
其中正确的是( )
(1)2Na+2NH3=2NaNH2+H2↑
(2)CaO+2NH4Cl=CaCl2+2NH3↑+H2O
(3)3Mg(NH2)2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2+4NH3↑
(4)NH4Cl+NaNH2=NaCl+2NH3↑
其中正确的是( )
| A. | 只有(3) | B. | 只有(2) | C. | (2)和(3) | D. | 都正确 |
10.将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
| A. | 参加反应的硝酸的物质的量为0.4mol | |
| B. | 加入合金的质量可能为9.6g | |
| C. | 沉淀完全时消耗NaOH溶液体积为150mL | |
| D. | 溶解合金时产生NO气体体积0.224L(以标准状况) |
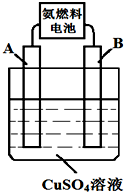 能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
 .
. .
.