题目内容
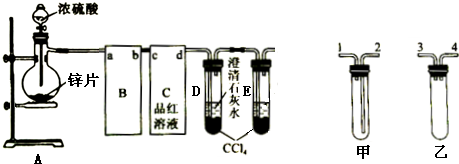
20. 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.
试管a中的现象是品红溶液褪色,作用是证明二氧化硫具有漂白性.
试管b中的现象是紫色石蕊试液变红,作用是证明二氧化硫溶于水显示酸性.
分析 (1)铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫为酸性氧化物,溶于水显示酸性.
解答 解:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字,反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,所以试管a中品红溶液褪色,目的是证明二氧化硫具有漂白性;二氧化硫属于酸性氧化物,溶于水后溶液显示酸性,能够使紫色的石蕊试液变红,
故答案为:品红溶液褪色;证明二氧化硫具有漂白性;紫色石蕊试液变红;证明二氧化硫溶于水显示酸性.
点评 本题考查了浓硫酸的性质、二氧化硫的性质及检验,题目难度中等,注意掌握铜与浓硫酸反应原理、二氧化硫气体的性质及检验方法,试题有利于提高学生灵活应用基础知识的能力.

练习册系列答案
相关题目
13.已知奥运会吉祥物的内充物为涤纶(结构简式为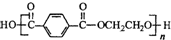 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )
 ,外用材料是纯羊毛线.则下列有关说法不正确的是( )
,外用材料是纯羊毛线.则下列有关说法不正确的是( )| A. | 羊毛的主要成分属于蛋白质 | |
| B. | 涤纶属于天然高分子化合物 | |
| C. | 合成涤纶的单体之一可以是HOCH2CH2OH | |
| D. | 可用灼烧的方法区别羊毛和涤纶 |
8.碳和氮的许多化合物在工农业生产和生活中有重要的作用.
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
①0~10min内,NO的平均反应速率v(NO)=0.042mol•L-1•min-1,T1℃时,该反应的平衡常数K=$\frac{9}{16}$;
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.5kJ•mol-1
②NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+116.5kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则反应2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)的△H=-87.0kJ•mol-1
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.
在T1℃时,反应进行到同时间测得各物质的浓度如下;30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所.
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,各物质浓度如表所示.根据上表中的数据判断改变的条件可能是bc(填字母编号).
a.加入一定量的活性炭 b.通入一定量的NO c.适当缩小容器的体积
d.加入合适的催化剂 e.升高温度
③30min后,如果将温度升高至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则 Q<0(填“>”或“<”).
15.N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)?4NO2(g)+O2(g)△H>0,T1温度下的部分实验数据为下列说法不正确的是( )
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
12.乙烷在光照条件下与氯气混合,最多可能产生物质的种类是( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 10种 |
9.下列物质中既能发生加成也能发生取代反应且同时能使溴水因反应褪色,也能使高锰酸钾酸性溶液褪色的是( )
| A. | 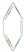 | B. | C6H14 | C. | 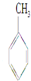 | D. |  |
10.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60,实验测得该物质属于离子化合物,且具有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性键 | |
| B. | K3C60中含有非极性共价键 | |
| C. | 1 mol K3C60中含有的阴离子个数为3×6.02×1023 | |
| D. | 该物质的化学式可写成KC20 |