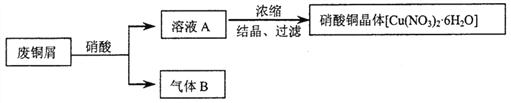
题目内容
【题目】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
已知:酸性强弱:H2SO3>H2CO3>HClO

(1)装置A中反应的化学方程式为________________________________________。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→( )→( ) →C→F。________
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________,通过_______________________现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_______________。

推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO![]() 氧化;
氧化;
原因二:SO2被Fe3+氧化;
原因三:________________________。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是______________________________。
【答案】 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O A→(B)→(D)→C→F 检验SO2是否除尽 C中品红溶液不褪色,E中石灰水变浑浊 BaSO4 SO2和Fe3+、酸性条件下NO3-都反应 取少量反应后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,说明反应后有Fe2+生成
【解析】试题分析:(1)装置A中Na2SO3与H2SO4(浓)反应生成Na2SO4、SO2、H2O;(2)次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断;A装置制备二氧化硫,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中;(3)根据(2)分析可得;(4)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;要验证原因二,Fe3+的还原产物是Fe2+,则选用K3[Fe(CN)6]验证亚铁离子;
解析:(1)装置A中Na2SO3与H2SO4(浓)反应生成Na2SO4、SO2、H2O,反应方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;(2)A装置制备二氧化硫,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则正确的装置连接顺序:A→(B)→(D)→C→F。(3)由(2)可知C的作用是检验SO2是否除尽;C中品红溶液不褪色,E中石灰水变浑浊证明亚硫酸酸性强于碳酸;(4)二氧化硫具有还原性,酸性条件下,能被硝酸根离子或铁离子氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;则原因三为SO2和Fe3+、酸性条件下NO3-都反应,证明Fe3+的还原产物是亚铁离子:取少量反应后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,说明反应后有Fe2+生成。

 名校课堂系列答案
名校课堂系列答案【题目】滴定法是化学上常用的定量分析的方法.滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等.
(1)甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000molL﹣1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
a.滴定时边滴边摇动锥形瓶,眼睛应观察 . (填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
b.判断滴定终点的现象是: .
c.根据下列数据:请计算待测盐酸溶液的浓度为 mol/L.
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
(2)乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量.实验如下:
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01molL﹣1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6 . 试回答下列问答:
a.步骤①发生的化学反应方程式为:;加入的指示剂是 .
b.步骤②应使用式滴定管.
c.氯的所测浓度比实际浓度会偏大,造成误差的原因可能是(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
(3)沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10﹣10 | 5.4×10﹣13 | 8.3×10﹣17 | 2.0×10﹣48 | 2.0×10﹣12 |
a.滴定时,你认为该滴定适宜选用的指示剂是下列中的 . (填序号)
A.KBrB.KIC.K2S D.K2CrO4
b.向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = .
= .
【题目】食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
弱酸 | CH3COOH | H2CO3 | HNO2 |
电离常数(25℃) | K=1.8×10﹣5 | K=4.3×10﹣7 | K=5.0×10﹣4 |
请回答下列问题:
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH﹣)c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3 , 所得混合液的pH=6,则混合液中 ![]() = .
= .
(3)常温下,将20mL 0.1molL﹣1 CH3COOH溶液和20mL0.1molL﹣1HNO2溶液分别与20mL 0.1 molL﹣1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是(填写序号);反应结束后所得两溶液中,c(CH3COO﹣) c(NO2﹣)(填“>”、“<”或“=”);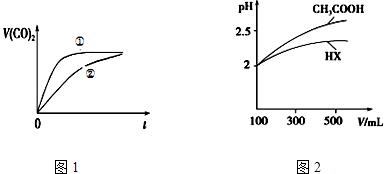
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3H2O的电离常数Kb= .
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:

已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。