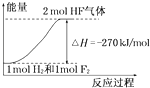
题目内容
【题目】已知A、E为金属单质,B是淡黄色粉末且常用于防毒面具中,回答下题。
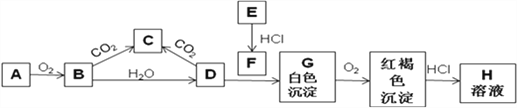
(1)实验室中A常常保存在盛放__________的广口瓶中。
(2)写出B转变成C的化学方程式_______________________。0.1molB参与该反应,转移电子的个数为_________ 。
(3)用化学方程式表示沉淀G颜色发生变化的原因:____________________________________________。
(4)从A、B、C、D、E、G、H选出试剂可制备F,写出对应离子方程式:______________________________________;
(5)直接向F溶液中加入B固体,写出可能出现的现象:______________________________
【答案】 煤油 2Na2O2+2CO2=2Na2CO3+O2 0.1NA 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Fe3++Fe=3Fe2+ 有无色气体生成,产生红褐色沉淀
【解析】(1)实验室中钠常常保存在盛放煤油的广口瓶中。(2)B转变成C的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,反应中过氧化钠既是氧化剂,也是还原剂,则0.1molB参与该反应,转移电子的个数为0.1NA。(3)氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,方程式为4Fe(OH)2 +O2 +2H2O=4Fe(OH)3。(4)可以用氯化铁与铁化合生成氯化亚铁,反应的离子方程式为2Fe3++Fe=3Fe2+;(5)过氧化钠具有强氧化性,溶于水生成氢氧化钠和氧气,则直接向氯化亚铁溶液中加入过氧化钠固体,可能出现的现象是有无色气体生成,产生红褐色沉淀。

【题目】某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的流程: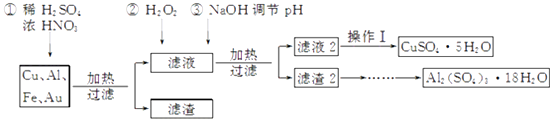
已知:Fe3+、Al3+、Cu2+开始沉淀至沉淀完全的pH范围分别为:2.2~3.2、4.1~5.0、5.3~6.6.
(1)得到滤渣1的主要成分为 .
(2)操作Ⅰ包含的实验步骤有:、冷却结晶、过滤、洗涤、干燥;过滤操作所用到的玻璃仪器有烧杯、玻璃棒和 .
(3)操作Ⅰ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 .
(4)第②步加H2O2后发生反应的离子方程式为 .
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K~523K,553K~687K,当温度在1 043K以上不再失重,下表列出了不同温度下的失重率:[硫酸铝晶体化学式为Al2(SO4)318H2O,相对分子质量为666]
已知:失重%= ![]() ×100%.
×100%.
温度(K) | 失重(%) | |
第一阶段 | 323~523 | 40.54 |
第二阶段 | 553~687 | 48.65 |
第三阶段 | 1 043以上 | 84.68 |
通过计算确定(写出计算过程):
①失重第一阶段分解产物的化学式;
②失重第二阶段反应的反应化学方程式.