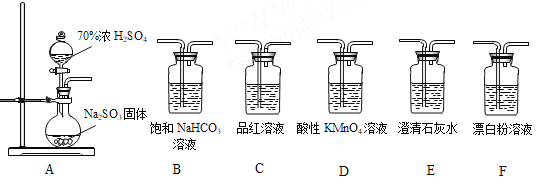
题目内容
【题目】25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题: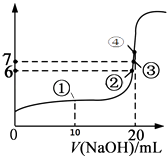
(1)若0.1mol/L的氢氟酸溶液中有0.1%的HF发生电离,则溶液的pH=;
(2)滴加NaOH溶液至恰好反应的过程中,水的电离程度(填写“逐渐增大”、“不变”、“逐渐减小”);
(3)①点时,NaOH加入了10mL,此时溶液中各种微粒(不包括水)的浓度由大到小的顺序是;
(4)③点时pH=7,此时溶液中c(F﹣)c(Na+)(填写>、<或=);
(5)④点时,NaOH加入了20mL,此时溶液中有两种微粒浓度之和等于0.05mol/L,这两种微粒是和;
(6)若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HF溶液的浓度,推测最好使用的指示剂为(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10).
【答案】
(1)4
(2)逐渐增大
(3)c(F﹣)>c(Na+)>c(HF)>c(H+)>c(OH﹣)
(4)=
(5)F﹣;HF
(6)酚酞
【解析】解:(1)0.1mol/L的氢氟酸溶液中有0.1%的HF发生电离,则c(H+)=0.1×0.1%=10﹣4mol/L,则pH=4;所以答案是:4;(2)酸抑制水的电离,氢离子浓度减小,则水的电离程度增大,滴加NaOH溶液至恰好反应的过程中,消耗氢离子,则氢离子浓度减小,所以水的电离程度逐渐增大;所以答案是:逐渐增大;(3)NaOH加入了10mL,溶液中溶质为等浓度的HF和NaF,溶液显酸性,则HF的电离程度大于F﹣的水解程度,而钠离子不水解,所以c(F﹣)>c(Na+)>c(HF)>c(H+)>c(OH﹣);所以答案是:c(F﹣)>c(Na+)>c(HF)>c(H+)>c(OH﹣);(4)溶液中电荷守恒为c(F﹣)+c(OH﹣)=c(Na+)+c(H+),pH=7,则c(OH﹣)=c(H+),所以c(F﹣)=c(Na+);所以答案是:=;(5)向20mL0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,NaOH加入了20mL,二者恰好反应生成NaF,其浓度为0.05mol/L,由于NaF部分水解生成HF,则由物料守恒可知,c(F﹣)+c(HF)=0.05mol/L;所以答案是:F﹣、HF;(6)NaOH与HF恰好反应生成NaF显碱性,选择在碱性条件下变色的指示剂,所以选择酚酞;所以答案是:酚酞.

【题目】如图是元素周期表的一部分 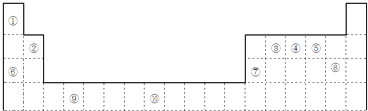
(1)元素⑩的次外层电子数为个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJmol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 . (填元素代号)
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 .