题目内容
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
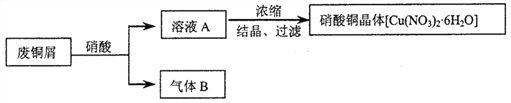
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
【答案】 5∶2 11mol·L-1 将生成的气体B和空气混合,再用水吸收重新利用(或将铜屑在空气中充分加热氧化,再用硝酸溶解)
【解析】(1)①废铜屑中铜和氧化铜的物质的量分别是xmol、ymol,则64x+80y=24;混合气体的物质的量是6.72L÷22.4L/mol=0.3mol,其中NO2和NO的体积比为2∶1,则NO2和NO的物质的量分别是0.2mol、0.1mol,根据电子得失守恒可知2x=0.2×1+0.1×3,解得x=0.25,所以y=0.1,因此废铜屑中铜和氧化铜的物质的量之比5∶2。②若测得溶液A中H+的浓度为1mol·L-1,即剩余硝酸的物质的量是0.1mol,生成硝酸铜是0.35mol,所以根据氮原子守恒可知原硝酸的物质的量浓度为(0.1+0.35×2+0.3)mol÷0.1L=11mol·L-1;(2)要防止原料的浪费,避免污染环境可以将生成的气体B和空气混合,再用水吸收重新利用或将铜屑在空气中充分加热氧化,再用硝酸溶解。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】某地环保部门取一定量某工厂所排酸性废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
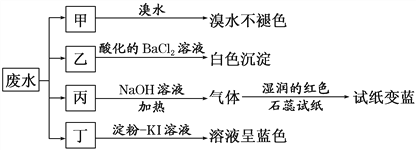
已知:废水试样中除H+外可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________________(填化学式,下同),离子Y是________________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为____________________________________________________________________________。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式: _____________________。