题目内容
【题目】滴定法是化学上常用的定量分析的方法.滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等.
(1)甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000molL﹣1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
a.滴定时边滴边摇动锥形瓶,眼睛应观察 . (填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
b.判断滴定终点的现象是: .
c.根据下列数据:请计算待测盐酸溶液的浓度为 mol/L.
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
(2)乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量.实验如下:
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01molL﹣1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6 . 试回答下列问答:
a.步骤①发生的化学反应方程式为:;加入的指示剂是 .
b.步骤②应使用式滴定管.
c.氯的所测浓度比实际浓度会偏大,造成误差的原因可能是(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
(3)沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10﹣10 | 5.4×10﹣13 | 8.3×10﹣17 | 2.0×10﹣48 | 2.0×10﹣12 |
a.滴定时,你认为该滴定适宜选用的指示剂是下列中的 . (填序号)
A.KBrB.KIC.K2S D.K2CrO4
b.向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = .
= .
【答案】
(1)B;溶液从无色变为浅红色,且半分钟内不变色;0.2000
(2)Cl2+KI=I2+2KCl;淀粉溶液;碱;ACE
(3)D;2.7×10﹣3
【解析】解:(1)a.根据溶液中颜色变化判断终点,所以眼睛应观察锥形瓶内溶液颜色的变化;
所以答案是:B;b.达到滴定终点时,溶液由酸性变中性,再加一滴NaOH溶液显碱性,溶液由无色变为浅红色,则达到终点的现象为:溶液从无色变为浅红色,且半分钟内不变色;
所以答案是:溶液从无色变为浅红色,且半分钟内不变色;c.舍去误差较大的数即第三组数据,得出V(标准)=20.00mL,
c(待测)= ![]() =
= ![]() =0.2000mol/L,
=0.2000mol/L,
所以答案是:0.2000;(2)a.氯气与碘化钾反应生成氯化钾和单质碘,其反应的方程式为:Cl2+KI=I2+2KCl;碘遇淀粉会变蓝色,可以用淀粉作指示剂;
所以答案是:Cl2+KI=I2+2KCl;淀粉;b.Na2S2O3溶液显碱性,所以要用碱式滴定管盛放;所以答案是:碱式滴定管;c.A. 配制标准Na2S2O3溶液定容时,加水超过刻度线,则标准溶液的浓度减小,滴定时,消耗的标准溶液的体积偏大,所以测定结果偏大,故A正确;
B.锥形瓶水洗后直接装待测水样,对测定结果无影响,故B错误;
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗,则标准溶液的浓度减小,滴定时,消耗的标准溶液的体积偏大,所以测定结果偏大,故C正确;
D 滴定到达终点时,俯视读出滴定管读数,读数偏小,则消耗的标准溶液的体积偏小,所以测定结果偏小,故D错误;
E 滴定前尖嘴部分有气泡,滴定后消失,消耗的标准溶液的体积偏大,所以测定结果偏大,故E正确;
所以答案是:ABE;(3)a.本题的指示剂的作用是指示出氯离子恰好沉淀完全,即让氯离子先沉淀,沉淀完全后,再滴入硝酸银溶液会生成一种颜色不同的沉淀来指示沉淀终点;
A.氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A错误;
B.依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B错误;
C.硫化银的Ksp很小,Ksp=[Ag+]2[S2﹣]=2.0×10﹣48 , 计算得到需要的银离子浓度[S2﹣]= ![]() ;Ksp(AgCl)=[Ag+][Cl﹣]=1.8×10﹣10 , [Cl﹣]=
;Ksp(AgCl)=[Ag+][Cl﹣]=1.8×10﹣10 , [Cl﹣]= ![]() ,通过计算得出硫化银也比氯化银先沉淀,故C错误;
,通过计算得出硫化银也比氯化银先沉淀,故C错误;
D.铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl﹣]=1.8×10﹣10 , Ksp(Ag2CrO4)=[Ag+]2[CrO42﹣]=2.0×10﹣12 , [Cl﹣]= ![]() ,[CrO42﹣]=
,[CrO42﹣]= ![]() ;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4 , 做指示剂可以正确的测定氯化物的含量,故D正确;
;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4 , 做指示剂可以正确的测定氯化物的含量,故D正确;
所以答案是:D;b.当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br﹣)= ![]() ,c(Cl﹣)=
,c(Cl﹣)= ![]() ,
,
则 ![]() =
= ![]() =
= ![]() =2.7×10﹣3;
=2.7×10﹣3;
所以答案是:2.7×10﹣3 .
【考点精析】通过灵活运用酸碱中和滴定,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点即可以解答此题.

 阅读快车系列答案
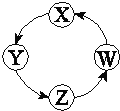
阅读快车系列答案【题目】下列各组物质中,满足表中图示物质在通常条件下能一步转化的组合只有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①②④
【题目】如图是元素周期表的一部分 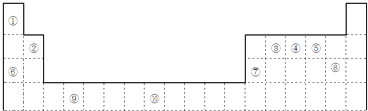
(1)元素⑩的次外层电子数为个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJmol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 . (填元素代号)
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 .