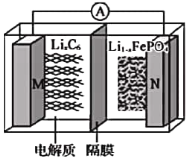
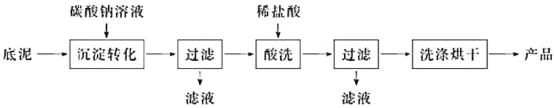
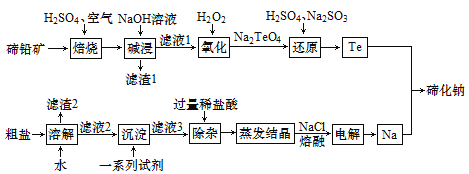
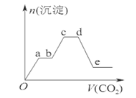
题目内容
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
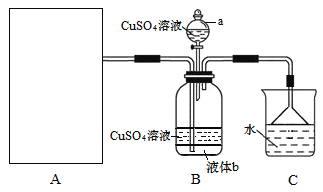
回答下列问题:
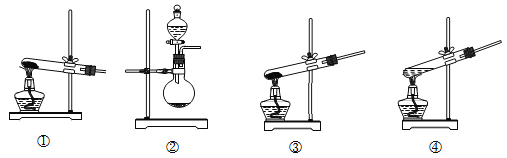
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
【答案】①②④ 分液漏斗 CCl4 防止倒吸 乙醇 淀粉溶液 滴入最后一滴,溶液蓝色褪去且半分钟不复色 98.4%或0.984
【解析】
(1)根据制取氨气使用的试剂的状态确定装置图的使用;
(2)根据仪器结构判断仪器名称,根据液体b密度比水大,与水互不相溶的性质分析物质,结合氨气极容易溶于水分析其作用;
(3)根据硫酸四氨合铜晶体为深蓝色晶体,溶于水,不溶于乙醇分析使用的物质;
(4)①根据I2遇淀粉溶液变为蓝色,选择使用的指示剂,I2会发生反应I2+2S2O32-=S4O62-+2I-,反应完全蓝色消去判断滴定终点;
②用关系式法找出Cu2+与S2O32-的关系,根据消耗的S2O32-的物质的量计算出Cu2+的物质的量及Cu(NH3)4]SO4·H2O的质量,进而可得其纯度。
(1)在实验室中,若用固体NH4Cl与Ca(OH)2混合加热制取氨气,应该选择①装置;若向CaO固体中加入浓氨水制取氨气,应该选择选项②;若用浓氨水直接加热制取氨气,则选择装置④;故合理选项是①②④;
(2)有仪器a结构可知该仪器名称为分液漏斗,由于液体b密度比水大,与水互不相溶,可确定该物质是四氯化碳,液体b的化学式CCl4;装置A是制取氨气,在装置B中与CuSO4溶于反应制取硫酸四氨合铜晶体,由于氨气极容易溶于水,为了充分吸收氨气,同时防止倒吸现象的发生,使用了CCl4,因此CCl4的作用是防止倒吸;
(3)由于硫酸四氨合铜晶体为深蓝色晶体,溶于水,不溶于乙醇,能在热水中分解,所以实验时可向所得溶液中加入乙醇来获得晶体;
(4)①Cu2+与I-反应产生I2,I2遇淀粉溶液变为蓝色,故可选择淀粉溶液为指示剂,Cu2+与I-反应产生I2,向该溶液中滴加Na2S2O3标准溶液,I2会发生反应I2+2S2O32-=S4O62-+2I-,当I2反应完全时,溶液的蓝色消去,据此判断滴定终点。实验现象是:滴入最后一滴,溶液蓝色褪去且半分钟不复色;
②Cu2+与过量I-作用,生成I2和CuI,反应方程式为:2Cu2++4I-=2CuI↓+I2,向该溶液中滴加Na2S2O3标准溶液,I2会发生反应I2+2S2O32-=S4O62-+2I-,可得关系式2Cu2+ ~I2~ 2S2O32-,反应消耗的S2O32-的物质的量n(S2O32-)=0.050mol/L×0.016L×![]() =0.004mol,则溶液中含有Cu2+的物质的量n(Cu2+)= n(S2O32-)=0.004mol,根据Cu元素守恒可知反应产生的[Cu(NH3)4]SO4·H2O]的物质的量是0.004mol,其质量是m{[Cu(NH3)4]SO4·H2O}=0.004mol×246g/mol=0.984g,因此该物质的纯度是(0.984g÷1.0g)×100%=98.4%=0.984。
=0.004mol,则溶液中含有Cu2+的物质的量n(Cu2+)= n(S2O32-)=0.004mol,根据Cu元素守恒可知反应产生的[Cu(NH3)4]SO4·H2O]的物质的量是0.004mol,其质量是m{[Cu(NH3)4]SO4·H2O}=0.004mol×246g/mol=0.984g,因此该物质的纯度是(0.984g÷1.0g)×100%=98.4%=0.984。

 阅读快车系列答案
阅读快车系列答案