题目内容
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
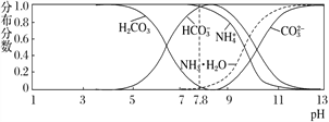
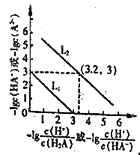
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
【答案】D
【解析】
试题A、根据示意图可知,当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),A错误;B、根据物料守恒可得NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(CO32-)+c(H2CO3)+c(HCO3-),因为NH4+发生水解反应,所以c(HCO3-)≠c(CO32-)+c(OH-)—c(H+),则B项中关系式错误,B错误;C、根据图像可知pH<7.8时,往该溶液中逐滴滴加氢氧化钠HCO3﹣浓度逐渐增大,C错误;D、因为0.1mol/L的NH4HCO3溶液pH=7.8,说明HCO3的水解程度大于NH4+的水解程度,根据越弱越水解的规律可得:Kb(NH3·H2O)>Ka1(H2CO3),D正确。答案选D。

练习册系列答案
相关题目