��Ŀ����
����Ŀ�����𡢵����ס�ͭ��п�Ļ�������������Ҫ��;���ش��������⣺
(1)��̬Bԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ____����̬Cu+�ĺ�������Ų�ʽΪ___��
(2)![]() �Ŀռ乹����________��HNO3�����Ա�HNO2ǿ���Դӽṹ�ĽǶȽ�����ԭ��_______________��
�Ŀռ乹����________��HNO3�����Ա�HNO2ǿ���Դӽṹ�ĽǶȽ�����ԭ��_______________��
(3)������(H3PO3)����Ԫ�ص�һ�ֺ����ᣬ��NaOH��Ӧֻ����NaH2PO3��Na2HPO3�����Σ���H3PO3���ӵĽṹʽΪ____��
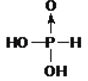
(4)Zn2+����CN������������(![]() )���γ��ȶ�����
)���γ��ȶ�����
��CN�� �ĽṹʽΪ_____��
��ÿ��������������У���ȡsp2�ӻ���ԭ����__����
���𰸡������λ�Ĵ��� [Ar]3d10 ƽ�������� HNO3�к��з��ǻ�����(HNO3�к���2�����ǻ�����HNO2�к���1�����ǻ��������ǻ���Խ������ԭ�ӵ�������Խ�ߣ������ǻ��������ĵ���������ԭ��ƫ�ƣ�Խ������������ӣ���HNO3�����Ա�HNO2ǿ) 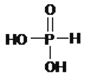 ��
��
![]() 16
16
��������
(1)s�ܼ���������״Ϊ���Ρ�p�ܼ����ӵ�������״Ϊ�����Σ�Cuʧȥ4s�ܼ���������Cu+��
(2)���ݼ۲���ӶԻ��������жϿռ�ṹ��
(3)�����������NaOH�IJ����֪������Ϊ��Ԫ�
(4)��Ѱ����Ϥ�ĵȵ������жϽṹʽ��
��˫��̼��˫�����Լ�����̼����sp2�ӻ���
(1)��̬Bԭ�ӵ���ռ������ܼ��ĵ���Ϊ2p���ӣ������������ͼΪ�����λ�Ĵ��Σ�CuΪ29��Ԫ�أ���������Ų�Ϊ[Ar]3d104s1��ʧȥ�����һ�������γ�Cu+������Cu+�ĺ�������Ų�Ϊ[Ar]3d10��
(2)![]() ����ԭ�Ӽ۲���Ӷ���Ϊ
����ԭ�Ӽ۲���Ӷ���Ϊ![]() �������µ��Ӷԣ�����Ϊƽ�������Σ�HNO3�к���2�����ǻ�����HNO2�к���1�����ǻ��������ǻ���Խ������ԭ�ӵ�������Խ�ߣ������ǻ��������ĵ���������ԭ��ƫ�ƣ�Խ������������ӣ���HNO3�����Ա�HNO2ǿ��
�������µ��Ӷԣ�����Ϊƽ�������Σ�HNO3�к���2�����ǻ�����HNO2�к���1�����ǻ��������ǻ���Խ������ԭ�ӵ�������Խ�ߣ������ǻ��������ĵ���������ԭ��ƫ�ƣ�Խ������������ӣ���HNO3�����Ա�HNO2ǿ��
(3)������ӦΪ��Ԫ�ᣬӦ���������ǻ������ԽṹʽΪ ��
�� ��
��
(4))��CN-��N2��Ϊ�ȵ����壬�ȵ�����������ƵĽṹ��N2�ĽṹʽΪN��N����CN-�ĵ���ʽΪ![]() ��
��
��ÿ��������������У�2��������12��̼ԭ��Ϊsp2�ӻ����γ�˫������ԭ�ӡ�̼ԭ�Ӻ�2����ԭ��ҲΪsp2�ӻ�������16����

 ϰ�⾫ѡϵ�д�
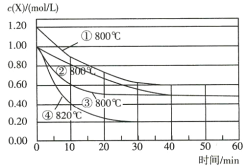
ϰ�⾫ѡϵ�д�����Ŀ�������仯�����ڹ�ũҵ������������������Ҫ���á����������գ�
�ϳɰ���ҵ�У�N2(g)+3H2(g)![]() 2NH3(g)��H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
2NH3(g)��H<0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ�����
t/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
��1���ԱȽ�K1��K2�Ĵ�С��K1________ K2����д����������=��������
��2��400��ʱ����Ӧ2NH3(g)![]() N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ����ֵΪ_____________�������NH3��N2��H2�����ʵ���Ũ�ȷֱ�Ϊ3mol/L��2mol/L��1mol/Lʱ����÷�Ӧ��(N2)(��)___________��(N2)(��)����д����������=��������
N2(g)+3H2(g)�Ļ�ѧƽ�ⳣ����ֵΪ_____________�������NH3��N2��H2�����ʵ���Ũ�ȷֱ�Ϊ3mol/L��2mol/L��1mol/Lʱ����÷�Ӧ��(N2)(��)___________��(N2)(��)����д����������=��������
��3�����ܱպ��ݵ������У���������Ϊ�ϳɰ���Ӧ�ﵽƽ������ݵ���____________��
a����(N2)������=3��(H2)���棩b�����������ܶȱ��ֲ���
c��������ѹǿ���ֲ���d��N2��H2��NH3��Ũ��֮��Ϊ1��3��2
��4����������Ϊ�����֡��족�֡��ࡱ���ö��ַ�������д������ϳɰ���ҵ��Ϊʵ�֡��ࡱ����ȡ�Ĵ�ʩ��__________________________��__________________________��
��5��0.1mol/L��(NH4)2SO4ˮ��Һ�и�����Ũ���ɴ�С��˳����_____________________���ڸ���Һ�м��������������壬��Һ��![]() ��Ũ��_______�����������С�����䡱������ԭ����___________________��
��Ũ��_______�����������С�����䡱������ԭ����___________________��
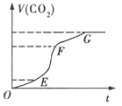
��6����ͼ��1molNO2��1molCO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ_____________________________________________��
����Ŀ�����Ϲ���Ὣ2019�궨Ϊ����ѧԪ�����ڱ�������������ʾ��Ԫ�������ɵ���Ҫ�ԡ��±��г���a~j10��Ԫ�������ڱ��е�λ�ã�
���� | IA | 0 | |||||||
1 | a | IIA | �� | IIIA | IVA | VA | VIA | VIIA | |
2 | b | �� | e | d | |||||
3 | c | f | �� | g | h | i | j |
(1)����Ԫ��b�ĵ�ز������������˽ܳ����ף�97��Ĺŵ��ɷ��ٻ�2019��ŵ������ѧ����bԭ�ӽṹʾ��ͼΪ____�������ع���ʱ����___��ת��Ϊ���ܡ�
(2)a~j10��Ԫ���У�������������K����������Ԫ����___��(������)����������ǿ��Ԫ����_____(дԪ�ط���)��
(3)Ԫ��g������������Ӧ��ˮ������NaOH��Һ��Ӧ�����ӷ���ʽΪ��_______��
(4)h��i��j����Ԫ�ص���̬�⻯���У����ȶ����⻯����______(д��ѧʽ)��
(5)Ԫ��i��һ�������ﳣ����Ư��ֽ������ñ��ȡ�����������л�ԭ�ԣ���һ�����������볣��������������Ӧ��д������һ����Ӧ�Ļ�ѧ����ʽ��_______ ��