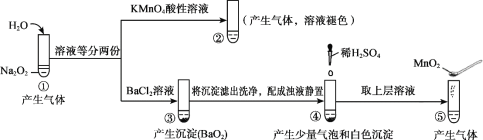
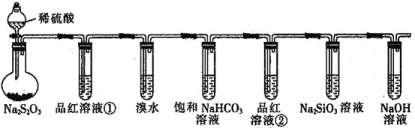
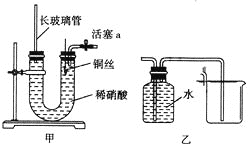
题目内容
【题目】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1________ K2(填写“>”、“=”或“<”)
(2)400℃时,反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数的值为_____________。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应υ(N2)(正)___________υ(N2)(逆)(填写“>”、“=”或“<”)
N2(g)+3H2(g)的化学平衡常数的值为_____________。当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,则该反应υ(N2)(正)___________υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________。
a.υ(N2)(正)=3υ(H2)(逆)b.混合气体的密度保持不变
c.容器内压强保持不变d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________,__________________________。
(5)0.1mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________,在该溶液中加入少量明矾固体,溶液中![]() 的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________。
的浓度_______(填“增大”、“减小”或“不变”),其原因是___________________。
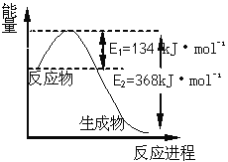
(6)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式_____________________________________________。
【答案】> 2 > c 采用20MPa~50MPa高压 及时将产物液化除去 c(NH4+)>c(SO42-)>c(H+)>c(OH-) 增大 NH4+水解呈酸性,Al3+水解也呈酸性,两者相互抑制,c(NH4+)增大 NO2(g)+CO(g)=CO2(g)+NO(g)△H =-234kJ/mol
【解析】
(1)对于N2(g)+3H2(g)![]() 2NH3(g)△H<0,温度升高,平衡逆向移动,K减小,即K1>K2,故答案为:>;
2NH3(g)△H<0,温度升高,平衡逆向移动,K减小,即K1>K2,故答案为:>;
(2)反应2NH3(g)![]() N2(g)+3H2(g)为反应N2(g)+3H2(g)
N2(g)+3H2(g)为反应N2(g)+3H2(g)![]() 2NH3(g)的逆反应,所以2NH3(g)
2NH3(g)的逆反应,所以2NH3(g)![]() N2(g)+3H2(g)的K=
N2(g)+3H2(g)的K=![]() =2,当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,QC=
=2,当测得NH3和N2、H2的物质的量浓度分别为3mol/L和2mol/L、1mol/L时,QC=![]() =
=![]() <2,反应正向进行,υ(N2)(正)>υ(N2)(逆),故答案为:2;>;
<2,反应正向进行,υ(N2)(正)>υ(N2)(逆),故答案为:2;>;
(3)N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
a.结合化学计量数可知:υ(N2)(正)=![]() υ(H2)(正),又因为υ(N2)(正)=3υ(H2)(逆),则
υ(H2)(正),又因为υ(N2)(正)=3υ(H2)(逆),则![]() υ(H2)(正)=3υ(H2)(逆),υ(H2)(正)≠υ(H2)(逆),反应未平衡,a错误;
υ(H2)(正)=3υ(H2)(逆),υ(H2)(正)≠υ(H2)(逆),反应未平衡,a错误;
b.体系中气体的总质量和体积始终保持不变,则混合气体的密度始终保持不变,即混合气体的密度保持不变,不能说明反应是否平衡,b错误;
c.恒容下,该反应的正反应是气体总物质的量减小的反应,若反应未平衡,压强将减小,容器内压强保持不变,说明反应已平衡,c正确;
d.N2、H2、NH3的浓度之比为1∶3∶2无法判断三者的浓度是否还会变化,也就无法判断反应是否已平衡,d错误;
故答案为:c;
(4)实现“多”,就要使合成氨反应尽可能向右进行,可采用增大压强的方式进行,实际生产中往往采用20MPa~50MPa高压,及时将产物液化除去等,故答案为:采用20MPa~50MPa高压;及时将产物液化除去;
(5)(NH4)2SO4是强电解质,完全电离,溶液中NH4+会水解,但水解是微弱的,所以NH4+浓度最大,SO42-不水解,其浓度小于NH4+,NH4+水解显酸性,H+浓度大于OH-浓度,即c(NH4+)>c(SO42-)>c(H+)>c(OH-),NH4+水解呈酸性,加入少量明矾固体,Al3+水解也呈酸性,两者相互抑制,c(NH4+)增大,故答案为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);增大;NH4+水解呈酸性,Al3+水解也呈酸性,两者相互抑制,c(NH4+)增大;
(6)由图可知,1molNO2和1molCO反应生成CO2和NO的![]() =E1-E2=134 kJ/mol -368 kJ/mol=-234kJ/mol,所以该反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H =-234kJ/mol。
=E1-E2=134 kJ/mol -368 kJ/mol=-234kJ/mol,所以该反应的热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H =-234kJ/mol。

 名校课堂系列答案
名校课堂系列答案【题目】已知反应O2(g)+2Cl2(g) ![]() 2Cl2O(g) △H>0,在三个恒温、恒容的密闭容器中分别充人lmolO2与2molCl2,测得平衡时O2的转化率如下表.下列说法正确的是( )
2Cl2O(g) △H>0,在三个恒温、恒容的密闭容器中分别充人lmolO2与2molCl2,测得平衡时O2的转化率如下表.下列说法正确的是( )
容器编号 | 温度(℃) | 容器体积/L | 平衡时O2转化率 | 平衡时压强(Pa) |
① | 200 | V1 | 50% | P1 |
② | 200 | V2 | 70% | P2 |
③ | 350 | V3 | 50% | P3 |
A. 反应速率:③>①>②
B. 平衡时压强:P1>P2
C. 容器体积:V1<V3
D. 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70%
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是 ( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A.该反应的正反应是吸热反应
B.恒温时减小容器体积增大压强,正反应速率增大
C.830 ℃时,反应达到平衡,一定是c(CO) = c(CO2)
D.400 ℃时,生成CO2物质的量越多,平衡常数K越大