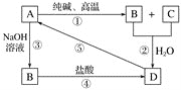
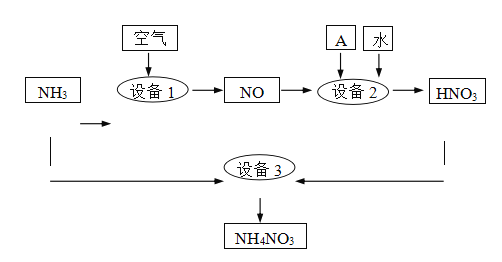
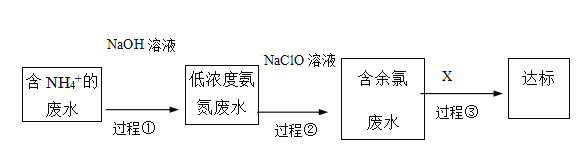
题目内容
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
【答案】A
【解析】分析:A、加入少量的NaOH固体,平衡向逆反应方向移动;
B、加入Na2CO3溶液,平衡向正方向移动;
C、恒温下向溶液中加入CaO,仍为饱和溶液,浓度不变;
D、Ca(OH)2的溶解度随温度的升高而降低。
详解:A、加入少量的NaOH固体,OH-浓度增大,平衡向逆方向移动,则Ca(OH)2的固体增多,A正确。
B、加入Na2CO3溶液,发生Ca2++CO32-=CaCO3↓,平衡向正方向移动,则Ca(OH)2的固体减少,B错误;
C、恒温下向溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍为饱和溶液,pH不变,但是由于水量减少,故溶解的碳酸钙减小,C错误;
D、给溶液加热,Ca(OH)2的溶解度降低,溶液pH减小,D错误;答案选A。

【题目】(题文)Ⅰ.化学课上老师演示了如下图的实验:
实验时,将两气球内的NaHCO3和Na2CO3同时倒入试管中。已知盐酸是足量的,且整套装置气密性良好,回答下列问题:
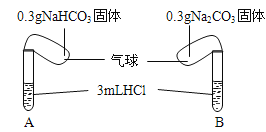
(1)实验过程中观察到的现象是:________________.
(2)实验结束后,两试管的气球大小有差异,大小气球(包含试管)体积之比约为(填最简单整数比)__________.
Ⅱ.当甲同学用手触摸上述试管时,意外发现A试管变冷,而B试管发热,他把这个发现告诉了同桌乙同学,并由此得出结论:NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.乙同学却对此结论却持怀疑的态度.为此,两位同学在课外活动中继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后温度 |
① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
(1)该研究报告的题目是《___________________________》.
(2)该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称是______________________.
(3)实验①和②的目的是_________________________________________________.
(4)通过上述实验可得出的结论是:___________________________________(写出两条即可).