题目内容
【题目】卫生部严令禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。过氧化钙(CaO2)常用作杀菌剂、防腐剂,是一种白色固体,带有结晶水,通常还含有CaO。
I、制备过氧化钙。
某实验小组选用如下装置制备过氧化钙。已知化学反应Ca2++H2O2+2NH3+xH2O===CaO2·xH2O↓+2NH4+。在碱性环境中制取CaO2·xH2O的装置如下图:
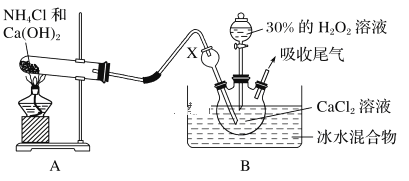
(1)装置B中仪器X的作用是_____________;反应在冰水浴中进行的原因是_________________。
(2)反应结束后,经________、________、低温烘干获得CaO2·xH2O。
II、含量测定。
(1)称取13.52 g过氧化钙样品,灼热时发生如下反应:2[CaO2·xH2O]→2CaO+O2↑+2xH2O,得到O2在标准状况下体积为672 mL,该样品中CaO2的物质的量为____________。
(2)另取同一样品13.52 g,溶于适量稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 7.0 g。样品中杂质CaO的质量为_____________;样品CaO2·xH2O中的x值为____________。
【答案】防倒吸防止温度过高使H2O2分解,且有利于晶体析出过滤洗涤0.06 mol0.56g8
【解析】
I、(1)装置B中仪器X的作用是导气,同时可以防止溶液倒吸,为了防止温度过高导致过氧化氢分解,并且有利于晶体析出,反应需要在冰水浴中进行,故答案为:防止倒吸;防止温度过高过氧化氢分解,有利于晶体析出;
(2)反应结束将B装置中三颈瓶中的物质过滤、洗涤、低温烘干干燥得到晶体,故答案为:过滤;洗涤.
II、(1)氧气的物质的量=![]() =0.03mol,根据方程式可知:n(CaO2)=n(CaO2xH2O)=2n(O2)=0.03mol×2=0.06mol,故答案为:0.06mol;
=0.03mol,根据方程式可知:n(CaO2)=n(CaO2xH2O)=2n(O2)=0.03mol×2=0.06mol,故答案为:0.06mol;
(2)①n总(Ca2+)=n(CaCO3)=![]() =0.07mol,根据钙离子守恒:n(CaO)=0.07mol-0.06mol=0.01mol,故m(CaO)=0.01mol×56g/mol=0.56g,故答案为:0.56g;
=0.07mol,根据钙离子守恒:n(CaO)=0.07mol-0.06mol=0.01mol,故m(CaO)=0.01mol×56g/mol=0.56g,故答案为:0.56g;
②水的质量=13.52g-0.56g-0.06mol×72g/mol=8.64g,其物质的量=![]() =0.48mol,故0.06x=0.48,则x=8,故答案为:8。
=0.48mol,故0.06x=0.48,则x=8,故答案为:8。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】(题文)Ⅰ.化学课上老师演示了如下图的实验:
实验时,将两气球内的NaHCO3和Na2CO3同时倒入试管中。已知盐酸是足量的,且整套装置气密性良好,回答下列问题:
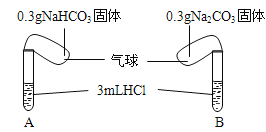
(1)实验过程中观察到的现象是:________________.
(2)实验结束后,两试管的气球大小有差异,大小气球(包含试管)体积之比约为(填最简单整数比)__________.
Ⅱ.当甲同学用手触摸上述试管时,意外发现A试管变冷,而B试管发热,他把这个发现告诉了同桌乙同学,并由此得出结论:NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.乙同学却对此结论却持怀疑的态度.为此,两位同学在课外活动中继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后温度 |
① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL水 | 3.2g Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10mL水 | 20℃ | 24.2℃ |
⑤ | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
(1)该研究报告的题目是《___________________________》.
(2)该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称是______________________.
(3)实验①和②的目的是_________________________________________________.
(4)通过上述实验可得出的结论是:___________________________________(写出两条即可).