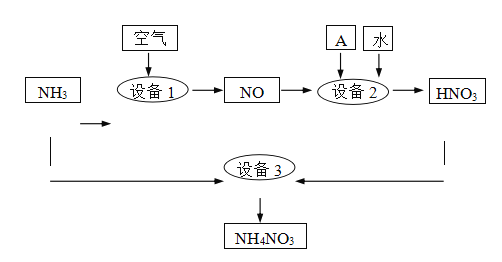
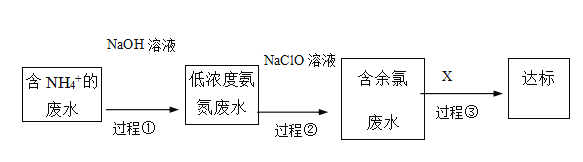
题目内容
【题目】纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到固体TiO2。用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为______________________
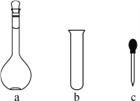
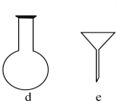
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是:____________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。
(3)滴定终点的现象是________________________________________。
(4)检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
【答案】 TiCl4+(x+2)H2O=TiO2·xH2O↓+4HCl 抑制铁离子的水解,防止生成沉淀 a、c 滴入最后一滴标准液(或滴定液),溶液颜色变红且30秒不褪色(或不恢复原色或不复色) 用一支试管取最后一次洗涤液少量,滴入几滴硝酸酸化的硝酸银溶液,若无白色沉淀,则已除净,反之未除净
【解析】分析:(1)TiCl4水解生成TiO2·xH2O和氯化氢,根据物质的性质和质量守恒定律书写化学方程式;
(2)根据铁离子水解解答;依据配制溶液实验过程和步骤分析;
检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在氯离子;
(3)根据铁离子与KSCN溶液发生显色反应分析;
(4)根据检验氯离子一般用硝酸酸化的硝酸银溶液解答。
详解:(1)设TiCl4的系数为1,根据元素守恒,TiO2xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),因此反应方程式为TiCl4+(x+2)H2O=TiO2·xH2O↓+4HCl;
(2)铁离子水解易使配制溶液变浑浊,应加对应酸抑制水解,由于不引入杂质,所以加硫酸抑制NH4Fe(SO4)2水解;配制溶液用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需容量瓶和胶头滴管,答案选ac;
(3)Fe3+与Ti3+反应,被还原为Fe2+,加入KSCN不显红色,当达到滴定终点时,再加入NH4Fe(SO4)2,溶液中Fe3+过量,所以滴入最后一滴NH4Fe(SO4)2,溶液会生成血红色的Fe(SCN)3,溶液会变成红色,因此滴定终点的现象是滴入最后一滴标准液(或滴定液),溶液颜色变红且30秒不褪色(或不恢复原色或不复色);
(4)沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+=AgCl↓可知检验TiO2·xH2O中Cl-是否被除净的方法是:用一支试管取最后一次洗涤液少量,滴入几滴硝酸酸化的硝酸银溶液,若无白色沉淀,则已除净,反之未除净。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案【题目】A、B、C、D四种不同物质之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是 ( )
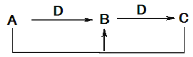
选项 | 假设 | 结论 |
A | A为NaOH溶液 | D可能是CO2 |
B | B为CO | C可能是CO2 |
C | C为FeCl2 ,D为Fe | A可能是盐酸 |
D | C为SO2 | A可能是H2S |
A. A B. B C. C D. D