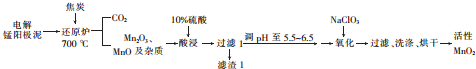
题目内容
3.铁在自然界分布广泛,在工业、农业和国防科技中有重要应用.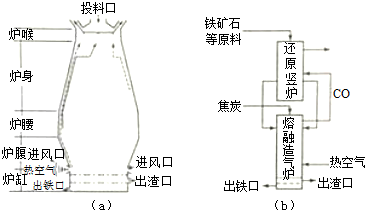
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示.原料中除铁矿石和焦炭外还有石灰石.除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;高炉排出气体的主要成分有N2、CO2和CO(填化学式).
(2)已知:①Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H=+494kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110kJ•mol-1
则反应Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)的△H=-355kJ•mol-1.理论上反应②③放出的热量足以供给反应①所需要的热量(填上述方程式序号).
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的炉腰部分,主要反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;熔融造气炉相当于高炉的炉腹部分.
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是碱液或氢氧化钠、氨水.
分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成二氧化碳;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)的△H,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:石灰石;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CO;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)△H=(+494kJ•mol-1)+3×(-283kJ•mol-1)=-355kJ•mol-1,
因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应,
故答案为:-355;②③;①;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应,则熔融造气炉相当于高炉的炉腹部分,
故答案为:炉腰;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;炉腹;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,
故答案为:碱液或氢氧化钠、氨水.
点评 本题为2015年海南考题,涉及高炉炼铁,侧重于化学与生产的考查,综合考查元素化合物知识,有利于培养学生良好的科学素养,难度中等.

 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 向蛋白质溶液中加入CuSO4溶液,蛋白质发生变性 | |
| B. | 一定条件下,乙醇能被氧化成一种刺激性气味的液体 | |
| C. | 用Cl2和NaOH溶液为原料制备次氯酸钠 | |
| D. | 海水提溴和生产玻璃过程中均涉及氧化还原反应 |
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共有电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
| A. | 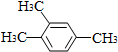 1,2,4-三甲苯 | B. | 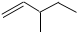 3-甲基戊烯 | C. | 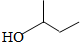 2-甲基-1-丙醇 | D. |  1,3-二溴丙烷 |
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| D. | 通过化学变化可以直接将水转变为汽油 |
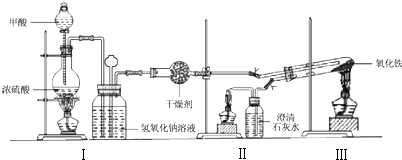
①按上图连接好装置,检查装置气密性.
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸.
③在完成某项操作后,点燃另外两处酒精灯.
④30min后熄灭酒精灯,关闭弹簧夹.
⑤待产物冷却至室温后,收集产物.
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物.
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为分液漏斗,该反应的化学方程式HCOOH $→_{△}^{浓硫酸}$CO↑+H2O.
(2)实验步骤③某项操作是指检验CO纯度.
(3)实验步骤④熄灭酒精灯的顺序为Ⅲ、I、II.(填Ⅰ,Ⅱ,Ⅲ)
(4)通过查资料获取如下信息:
Ⅰ.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃.
Ⅱ.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4.试分析酒精灯加热条件下生成Fe的原因是长时间集中加热使局部温度达到还原生成铁所需要的温度.
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%.
利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe.请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为12:1.(要求保留整数)