题目内容
8.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+mY(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
分析 A.平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变,说明反应前后气体计量数之和不变;
B.平衡常数只与温度有关,温度不变,平衡常数不变;
C.设第一次达到平衡状态时X参加反应的物质的量为amol,根据转化率=$\frac{参加反应的物质的量}{初始物质的量}×100%$进行计算;
D.该反应的反应前后气体计量数之和不变,第一次反应是按照X、Y的计量数之比来投料,所以第二次平衡与第一次平衡是等效平衡,两次平衡后各物质的含量不变,据此解答.
解答 解:A.平衡时,X、Y、Z的体积分数分别为30%、60%、10%,在此平衡体系中加入1molZ(g),再将达到平衡后,X、Y、Z的体积分数不变,说明反应前后气体计量数之和不变,所以m=2,故A正确;
B.平衡常数只与温度有关,温度不变,平衡常数不变,所以两次平衡的平衡常数相同,故B正确;
C.设第一次达到平衡状态时X参加反应的物质的量为amol,
X(g)+2Y(g)?3Z(g)
开始(mol) 1 2 0
转化(mol) a 2a 3a
平衡(mol)(1-a)(2-2a) 3a
相同条件下,气体的体积与物质的量成正比,所以其体积分数等于其物质的量分数,即(1-a):(2-2a):3a=30%:60%:10%,所以a=0.1,则参加反应的△n(X)=0.1mol、△n(Y)=0.2mol,
转化率=$\frac{参加反应的物质的量}{初始物质的量}×100%$,
X的转化率=$\frac{0.1mol}{1mol}×100%$=10%,Y的转化率=$\frac{0.2mol}{2mol}×100%$=10%,所以X和Y的转化率之比为1:1,故C正确;
D.该反应的反应前后气体计量数之和不变,第一次反应是按照X、Y的计量数之比来投料,所以第二次平衡与第一次平衡是等效平衡,两次平衡后各物质的含量不变,投入Z后,设Z参加反应的物质的量为3bmol,
X(g)+2Y(g)?3Z(g)
第一次平衡(mol):0.9 1.8 0.3
加入1molZ:0.9 1.8 1.3
转化:b 2b 3b
第二次平衡(mol):(0.9+b) (1.8+2b)(1.3-3b)
各物质含量不变,所以(0.9+b):(1.8+2b):(1.3-3b)=30%:60%:10%=3:6:1,
b=0.3,n(Z)=(1.3-0.9)mol=0.4mol,Z的物质的量浓度=$\frac{0.4mol}{2L}$=0.2mol/L,故D错误;
故选D.
点评 本题为2015年高考题,考查化学平衡计算、等效平衡、平衡常数等知识点,侧重考查学生分析计算能力,注意平衡常数、电离平衡常数、溶度积常数、盐类水解平衡常数都只与温度有关,与浓度无关,难点是D选项计算,题目难度中等.

 新思维寒假作业系列答案
新思维寒假作业系列答案| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 深入农村和社区宣传环保知识 | |
| D. | 经常使用一次性筷子、纸杯、塑料袋等 |
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |
| A. | 键角是确定多原子分子立体结构(分子形状)的重要参数 | |
| B. | 通过反应物和生成物分子中键能数据可以粗略预测反应热的大小 | |
| C. | 共价键的键长越长,键能则越小,共价化合物也就越稳定 | |
| D. | 同种原子间形成的共价键键长:叁键<双键<单键 |
| A. | 用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3 | |
| B. | 用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性 | |
| C. | 用反应热数据的大小,可判断不同反应的反应速率的快慢 | |
| D. | 用原子半径数据,可推断某些原子氧化性或还原性的强弱 |
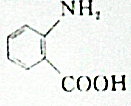 的同分异构体的结构简式:
的同分异构体的结构简式: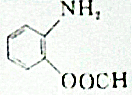 .
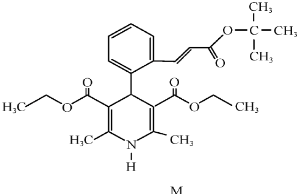
.
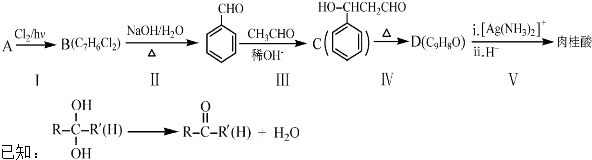
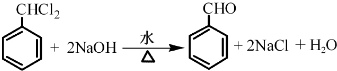 .
.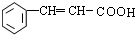 .
.