题目内容
5.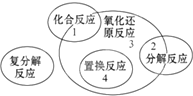 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ 2HCl | ||
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | D. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
分析 由图可知,区域3所表示的反应是氧化还原反应,但不是置换反应,不是化合反应,不是分解反应,有元素化合价变化的反应为氧化还原反应,以此来解答.
解答 解:A.该反应是氧化还原反应,但又是置换反应,不属于区域3,故A错误;
B.反应是氧化还原反应,也是化合反应,不属于区域3,故B错误;
C.反应是氧化还原反应,是分解反应,不属于区域3,故C错误;
D.反应是氧化还原反应,不是置换反应,不是化合反应,不是分解反应,属于区域3,故D正确.
故选D.
点评 本题考查氧化还原反应及四种基本反应类型,明确反应的分类及反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是( )
| A. | NH${\;}_{4}^{+}$、Cu2+、Cl-、NO${\;}_{4}^{2-}$ | B. | K+、Na+、CO${\;}_{3}^{2-}$、S2- | ||
| C. | K+、Na+、CH3COO-、SO${\;}_{4}^{2-}$ | D. | Ba2+、Mg2+、HCO${\;}_{3}^{-}$、Cl- |
13.制取水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H>0,欲提高反应的速率和C(s)的转化率,可采用的措施为( )
| A. | 降温 | B. | 增大水蒸气的浓度 | ||
| C. | 增大C(s)的量 | D. | 增大压强 |
10.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | NA个N2分子与NA个CO分子的质量比为1:1 | |
| B. | 水的摩尔质量等于NA个水分子的相对质量之和 | |
| C. | 在常温常压下11.2LN2含有的分子数为0.5NA | |
| D. | 1mol•L-1NaCl溶液中、含有NA个Na+ |
17.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | Al、Fe、Cu三者的单质放置在空气中均只生成氧化物 | |
| C. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
6.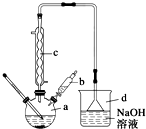 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)仪器a的名称是三颈烧瓶.
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.