ћвƒњƒЏ»Ё
≥£ќ¬≥£—єѕ¬,љЂa mol CO2∆шћеЌ®»л1 L b mol/LµƒNaOH»№“Ї÷–,ѕ¬Ѕ–ґ‘Ћщµ√»№“Їµƒ√и ц≤ї’э»Јµƒ «£® £©
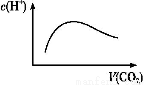
A.µ±a=2b ±,Ћж„≈CO2∆шћеµƒЌ®»л,»№“Ї÷–”…ЋЃµзјл≥цµƒc(H+)”–»зЌЉ±дїѓєЎѕµ
B.µ±a=b ±,Ћщµ√»№“Ї÷–іж‘Џ:c(OH-)+c(C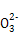 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
C.µ±2a=b ±,Ћщµ√»№“Ї÷–іж‘Џ:c(Na+)£Њc(C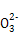 )£Њc(OH-)£Њc(HC
)£Њc(OH-)£Њc(HC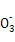 )£Њc(H+)
)£Њc(H+)
D.µ±1/2£Љa/b£Љ1 ±,Ћщµ√»№“Ї÷–“їґ®іж‘Џ:c(Na+)=c(C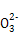 )+c(HC
)+c(HC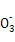 )+c(H2CO3)
)+c(H2CO3)
D
°Њљвќц°њµ±a=2b ±,ЋжCO2µƒЌ®»лCO2ЇЌNaOHЈі”¶ѕ»…ъ≥…Na2CO3,Љћґш…ъ≥…NaHCO3,„оЇуєэЅњµƒCO2“‘H2CO3–ќ љіж‘Џ”Џ»№“Ї÷–,”…”Џ—ќµƒЋЃљвіўљшЋЃµƒµзјл,ґшЋбїтЉо“÷÷∆ЋЃµƒµзјл,Aґ‘;µ±a=b ±,CO2ЇЌNaOHЈі”¶…ъ≥…NaHCO3,ЄщЊЁ÷ „” ЎЇгњ…÷™c(OH-)=c(H2CO3)+[c(H+)-c(C )],Bґ‘;µ±2a=b ±,CO2ЇЌNaOHЈі”¶…ъ≥…Na2CO3,c(OH-)”…C
)],Bґ‘;µ±2a=b ±,CO2ЇЌNaOHЈі”¶…ъ≥…Na2CO3,c(OH-)”…C ЋЃљвЇЌЋЃµƒµзјлЅљ≤њЈ÷ћбє©,є c(OH-)£Њc(HC
ЋЃљвЇЌЋЃµƒµзјлЅљ≤њЈ÷ћбє©,є c(OH-)£Њc(HC ),Cґ‘;µ±1/2£Љa/b£Љ1 ±,CO2ЇЌNaOHЈі”¶…ъ≥…Na2CO3°ҐNaHCO3,ЄщЊЁќпЅѕ ЎЇг,c(Na+)£Њc(C
),Cґ‘;µ±1/2£Љa/b£Љ1 ±,CO2ЇЌNaOHЈі”¶…ъ≥…Na2CO3°ҐNaHCO3,ЄщЊЁќпЅѕ ЎЇг,c(Na+)£Њc(C )+c(HC
)+c(HC )+c(H2CO3)£Њ
)+c(H2CO3)£Њ c(Na+),Dін°£
c(Na+),Dін°£

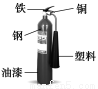
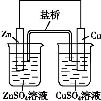
µз„”є§“µ≥£”√30%µƒFeCl3»№“ЇЄѓ іЈу‘ЏЊш‘µ∞е…ѕµƒЌ≠≤≠,÷∆‘м”°ЋҐµз¬Ј∞е°£ƒ≥є§≥ћ ¶ќ™ЅЋі”Јѕ“Ї÷–їЎ ’Ќ≠,÷Ў–¬їсµ√FeCl3»№“Ї,…иЉ∆ЅЋѕ¬Ѕ– µ—й≤љ÷и:

–і≥ц“їЄцƒ№÷§√чїє‘≠–‘Fe±»Cu«њµƒјл„”Јљ≥ћ љ: °£
Є√Јі”¶‘Џ…ѕЌЉ≤љ÷и ÷–ЈҐ…ъ°£«лЄщЊЁ…ѕ цЈі”¶…иЉ∆“їЄц‘≠µз≥Ў,‘ЏЈљњт÷–ї≠≥цЉт“„„∞÷√ЌЉ(±к≥цµзЉЂ√ы≥∆°ҐµзЉЂ≤ƒЅѕ°Ґµзљв÷ »№“Ї)°£
|
…ѕ цєэ≥ћїЎ ’µƒЌ≠ «і÷Ќ≠,ќ™ЅЋїсµ√ЄьіњµƒЌ≠±Ў–лљш––µзљвЊЂЅґ°£–і≥цµзљвЊЂЅґ ±—фЉЂ≤ƒЅѕЉ∞÷ч“™µƒµзЉЂЈі”¶ љ °£
“—÷™Їѕ≥…∞±Јі”¶N2(g)+3H2(g) 2NH3(g) ¶§H=-92.20 kJ°§mol-1,‘Џƒ≥ќ¬ґ»ѕ¬2 Lµƒ√№±’»Ё∆ч÷–љш––,≤вµ√»зѕ¬ эЊЁ:
2NH3(g) ¶§H=-92.20 kJ°§mol-1,‘Џƒ≥ќ¬ґ»ѕ¬2 Lµƒ√№±’»Ё∆ч÷–љш––,≤вµ√»зѕ¬ эЊЁ:
±Љд(h) ќп÷ µƒЅњ(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | n5 |
H2 | 4.50 | 4.20 | 3.60 | n4 | n6 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
ѕ¬Ѕ–ЋµЈ®’э»Јµƒ «£® £©
A.Јі”¶3 hƒЏ,Јі”¶Ћў¬ v(N2)ќ™0.17 mol°§L-1°§h-1
B.іЋќ¬ґ»ѕ¬,Є√Јі”¶µƒ∆љЇв≥£ эќ™0.037
C.Јі”¶љш––µљ1 h ±Ј≈≥цµƒ»»Ѕњќ™9.22 kJ
D.4 h ±,»ф‘ўЉ”»л1 mol N2,іпµљ–¬µƒїѓ—І∆љЇв ±,N2µƒ„™їѓ¬ «‘≠јіµƒЅљ±ґ